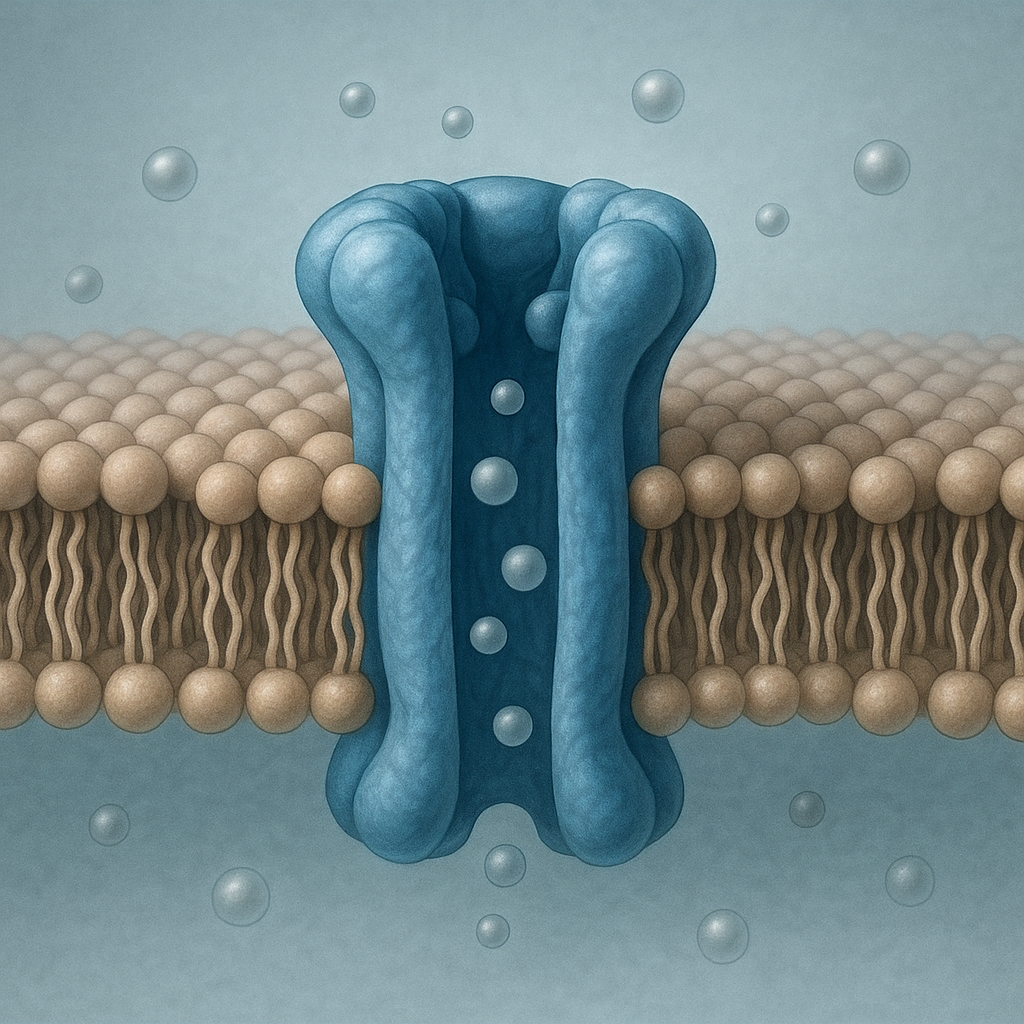
Kanały jonowe należą do najważniejszych struktur błon komórkowych, decydujących o tym, jak komórki porozumiewają się między sobą, reagują na bodźce i utrzymują stabilne środowisko wewnętrzne. Te wyspecjalizowane białka, osadzone w dwuwarstwie lipidowej, selektywnie przepuszczają określone jony, umożliwiając powstawanie sygnałów elektrycznych, regulację objętości komórki oraz przebieg wielu procesów fizjologicznych – od skurczu mięśnia po myślenie i odczuwanie bólu.
Budowa i podstawowe właściwości kanałów jonowych
Kanał jonowy to integralne białko błonowe, które tworzy w dwuwarstwie lipidowej hydrofilny por, wypełniony wodą, przez który mogą przemieszczać się naładowane cząstki – jony. Kluczową cechą jest jego selektywność, czyli zdolność do przepuszczania jednego typu jonów (np. Na⁺, K⁺, Ca²⁺, Cl⁻) z jednoczesnym blokowaniem innych. Selektywność wynika z precyzyjnie ukształtowanego filtra selektywnego – fragmentu kanału, w którym oddziaływania elektrostatyczne i przestrzenne dopasowują jon niczym zamek do klucza.
Większość kanałów jonowych zbudowana jest z kilku podjednostek białkowych (podjednostek alfa, beta, czasem gamma), które razem tworzą strukturę przypominającą cylinder. Wnętrze cylindra stanowi por przewodzący jony, a zewnętrzne fragmenty łączą się z lipidami błony lub innymi białkami. Charakterystyczną cechą jest obecność tzw. bramki – ruchomej części kanału, która może otwierać się lub zamykać w odpowiedzi na bodziec. Dzięki temu kanały są nie tylko selektywne, ale też regulowane czasowo i przestrzennie.
Podstawowe właściwości kanałów jonowych obejmują:
- wysoką przepuszczalność – pojedynczy kanał może przewodzić nawet milion jonów na sekundę, co pozwala na bardzo szybkie zmiany potencjału błonowego;
- bramkowanie – przechodzenie między stanem otwartym, zamkniętym i nieaktywnym;
- wysoką specyficzność farmakologiczną – wiele leków i toksyn wiąże się z określonymi kanałami, blokując lub modulując ich działanie;
- wrażliwość na zmiany środowiska – pH, potencjał błonowy, stężenie jonów, obecność cząsteczek sygnałowych.
W przeciwieństwie do transporterów czy pomp jonowych, kanały nie zużywają bezpośrednio energii z ATP; przepływ jonów zachodzi zgodnie z ich gradientem elektrochemicznym. Oznacza to, że kierunek i szybkość ruchu zależą od różnicy stężeń i ładunku po obu stronach błony. Błona komórkowa, wyposażona w liczne kanały, staje się zatem dynamiczną barierą, która nie tylko oddziela środowiska, ale przede wszystkim bardzo precyzyjnie dawkuje wymianę ładunków.
Rodzaje kanałów jonowych i mechanizmy bramkowania
Istnieje wiele typów kanałów jonowych, które można klasyfikować według rodzaju przepuszczanych jonów, mechanizmu otwierania, lokalizacji w organizmie czy budowy molekularnej. Z funkcjonalnego punktu widzenia najistotniejszy jest podział na kanały bramkowane napięciem, ligandem, mechanicznie oraz kanały przeciekowe. Każdy z tych typów pełni odrębną rolę w fizjologii komórki i ma inne znaczenie kliniczne.
Kanały bramkowane napięciem
Kanały bramkowane napięciem reagują na zmiany potencjału elektrycznego po obu stronach błony. Gdy różnica ładunków osiąga określony próg, fragment białka nazywany sensorem napięcia zmienia swoją konformację, otwierając por. Typowymi przedstawicielami są kanały sodowe (Naᵥ), potasowe (Kᵥ) i wapniowe (Caᵥ). Umożliwiają one powstawanie i propagację potencjału czynnościowego w neuronach oraz komórkach mięśniowych.
W neuronie kanały Naᵥ błyskawicznie otwierają się po niewielkiej depolaryzacji, co wywołuje nagły napływ jonów Na⁺ i dalsze zwiększenie dodatniego ładunku wewnątrz komórki. Krótko po otwarciu ulegają one inaktywacji, a ich miejsce w regulacji potencjału błonowego zajmują kanały Kᵥ, które wypuszczają K⁺ na zewnątrz, przywracając stan wyjściowy. Złożona sekwencja otwierania i zamykania tych kanałów jest podstawą przewodzenia impulsów w całym układzie nerwowym.
Kanały bramkowane ligandem
Kanały bramkowane ligandem otwierają się w odpowiedzi na przyłączenie określonej cząsteczki – może to być neuroprzekaźnik, nukleotyd (ATP, cGMP), jon (np. Ca²⁺) lub inny sygnał wewnątrzkomórkowy. Przyłączenie liganda do miejsca wiązania wywołuje zmianę konformacji białka prowadzącą do rozszerzenia poru przewodzącego. Tak działają m.in. receptory jonotropowe dla acetylocholiny (nikotynowe), glutaminianu (NMDA, AMPA), GABA czy glicyny.
Synapsa chemiczna między neuronami ilustruje znaczenie tych kanałów. Uwolnienie neuroprzekaźnika z zakończenia presynaptycznego powoduje jego przyłączenie do kanałów jonowych w błonie postsynaptycznej, co bardzo szybko zmienia przewodność dla określonych jonów. W efekcie powstaje lokalna depolaryzacja lub hiperpolaryzacja, która może doprowadzić do wygenerowania nowego potencjału czynnościowego. Kanały te są więc podstawą komunikacji synaptycznej, uczenia się i pamięci.
Kanały bramkowane mechanicznie i inne typy
Kanały bramkowane mechanicznie otwierają się pod wpływem sił fizycznych działających na błonę komórkową, takich jak rozciąganie, ucisk czy ścinanie. Biorą udział w zmysłach dotyku, słuchu, równowagi czy propriocepcji. Przykładem są kanały w komórkach rzęsatych ucha wewnętrznego, które reagują na wychylenia błonki pokrywającej, zmieniając napływ jonów i generując sygnały słuchowe.
Odrębną grupę stanowią kanały przeciekowe, stale częściowo otwarte, które tworzą tło przewodności błonowej. Dzięki nim utrzymuje się spoczynkowy potencjał błonowy i równowaga jonowa w komórce. Istnieją także złożone kanały regulowane przez cykliczne nukleotydy, fosforylację, poziom tlenu czy inne parametry metaboliczne. Wiele z nich pełni funkcję czujników stanu energetycznego komórki lub stresu środowiskowego.
Każda z tych grup kanałów może być dalej dzielona na liczne podtypy o nieco odmiennej budowie i farmakologii. Na przykład kanały potasowe obejmują szeroką rodzinę białek różniących się czasem aktywacji, szybkością inaktywacji, regulacją przez Ca²⁺ czy ATP. Dzięki takiej różnorodności komórka ma niezwykle finezyjne możliwości modulowania swojej elektrycznej aktywności.
Znaczenie kanałów jonowych w fizjologii komórek i organizmu
Rola kanałów jonowych w organizmach wielokomórkowych jest wszechstronna. Od ich działania zależy praca układu nerwowego, mięśniowego, sercowo-naczyniowego, hormonalnego, a także funkcje nerek, zmysłów i układu odpornościowego. Chociaż kojarzone są głównie z neuronami, pełnią kluczową funkcję także w komórkach nabłonkowych, komórkach beta trzustki, limfocytach czy komórkach śródbłonka naczyń krwionośnych.
Generowanie i przewodzenie sygnałów nerwowych
Układ nerwowy opiera się na zdolności neuronów do szybkich i odwracalnych zmian potencjału błonowego. Spoczynkowy potencjał, zwykle około -70 mV, jest efektem nierównomiernego rozmieszczenia jonów Na⁺, K⁺, Cl⁻ i anionów białczanowych oraz działania pomp jonowych. Kanały jonowe, głównie sodowe i potasowe, odpowiadają za dynamiczne odchylenia od tego stanu – potencjały czynnościowe. Dzięki kaskadowemu otwieraniu się kanałów bramkowanych napięciem impuls nerwowy może wędrować na znaczne odległości, bez utraty amplitudy.
W synapsach kanały jonowe bramkowane ligandem przekształcają sygnał chemiczny (neuroprzekaźnik w szczelinie synaptycznej) w sygnał elektryczny (zmiana przewodności błonowej postsynaptycznej). Równowaga między pobudzającymi a hamującymi kanałami jonowymi decyduje o tym, czy neuron wyśle kolejny impuls. Zaburzenia funkcjonowania tych kanałów leżą u podłoża wielu chorób neurologicznych i psychiatrycznych, takich jak padaczka, lęk, schizofrenia czy zaburzenia nastroju.
Skurcz mięśni i praca serca
W mięśniach szkieletowych i sercu kanały jonowe regulują sprzężenie pobudzenie–skurcz. Depolaryzacja błony komórkowej mięśnia, wywołana napływem Na⁺, prowadzi do otwarcia kanałów wapniowych i gwałtownego wzrostu stężenia Ca²⁺ w cytoplazmie. Jony wapnia wiążą się z białkami kurczliwymi (troponiną, kalmoduliną), uruchamiając przesuwanie się filamentów miozyny i aktyny, co objawia się skurczem. Kanały potasowe, uczestnicząc w repolaryzacji, wyznaczają czas trwania skurczu i częstotliwość pobudzeń.
W kardiomiocytach szczególne znaczenie mają wyspecjalizowane kanały odpowiedzialne za homeostazę jonową oraz generowanie rytmu serca. Układ przewodzący serca (węzeł zatokowo-przedsionkowy, przedsionkowo-komorowy, włókna Purkinjego) zawiera kanały o powolnej aktywacji i samorzutnym rozładowaniu, co pozwala na automatyczne generowanie potencjałów czynnościowych. Zmiany w ekspresji lub funkcji kanałów sodowych, wapniowych i potasowych mogą prowadzić do arytmii, a nawet nagłego zatrzymania krążenia.
Regulacja wydzielania hormonów i funkcji narządów
Kanały jonowe uczestniczą także w kontroli wydzielania hormonów i licznych substancji biologicznie czynnych. Komórki beta trzustki wykorzystują kanały potasowe zależne od ATP do „wykrywania” stężenia glukozy we krwi. Wzrost glikemii zwiększa ilość ATP w komórce, co prowadzi do zamknięcia tych kanałów i depolaryzacji błony. Otwierają się wówczas kanały wapniowe, a napływ Ca²⁺ wyzwala egzocytozę pęcherzyków z insuliną.
W nerkach różne typy kanałów sodowych, potasowych i chlorkowych odpowiadają za precyzyjne dostosowanie składu moczu i objętości płynów ustrojowych. Kanały te są celem działania wielu hormonów, takich jak aldosteron czy wazopresyna, które modulują ich liczbę i aktywność w błonie komórek nabłonkowych kanalików nerkowych. Dzięki temu organizm potrafi utrzymać równowagę wodno-elektrolitową nawet przy dużych wahaniach poboru płynów i soli.
W układzie odpornościowym kanały jonowe wpływają na aktywację limfocytów, proliferację i wydzielanie cytokin. Zmiany w potencjale błonowym limfocytu są ważnym elementem odpowiedzi na bodźce antygenowe, a kanały wapniowe odgrywają zasadniczą rolę w przekazywaniu sygnału z receptorów powierzchniowych do wnętrza komórki. Coraz lepiej rozumiane znaczenie kanałów w komórkach układu immunologicznego otwiera nowe możliwości terapii chorób autoimmunologicznych i nowotworów.
Rola w zmysłach i adaptacji do środowiska
Zmysły – wzrok, słuch, smak, węch, dotyk – w znacznym stopniu opierają się na selektywnej aktywności kanałów jonowych. W siatkówce oka kanały sodowe i wapniowe uczestniczą w przekształcaniu energii świetlnej w sygnał elektryczny. W komórkach rzęsatych ucha kanały mechanowrażliwe reagują na mikroskopijne ruchy błony podstawnej. Receptory smakowe i węchowe korzystają z kaskad wtórnych przekaźników, które ostatecznie regulują otwieranie kanałów jonowych, kodując informacje o jakości bodźca.
Dodatkowo, kanały jonowe pełnią funkcję czujników warunków środowiskowych – temperatury, pH, osmolarności. Należące do rodziny TRP (Transient Receptor Potential) kanały są aktywowane przez ciepło, zimno, substancje chemiczne i bodźce mechaniczne. W ten sposób organizm uzyskuje informację nie tylko o bezpośrednich bodźcach zmysłowych, ale także o zmianach fizykochemicznych otoczenia, co jest kluczowe dla przetrwania i zachowania homeostazy ustrojowej.
Choroby kanałopatie i znaczenie kliniczne kanałów jonowych
Ponieważ kanały jonowe kontrolują tak wiele procesów fizjologicznych, mutacje w genach je kodujących lub zmiany w ich regulacji prowadzą do szerokiego spektrum chorób określanych ogólnie jako kanałopatie. Mogą one dotyczyć układu nerwowego, mięśni, serca, nerek, trzustki i wielu innych tkanek. Zrozumienie molekularnych mechanizmów tych schorzeń umożliwiło w ostatnich dekadach rozwój celowanych terapii, wykorzystujących specyficzne modulatory kanałów.
Kanałopatie neurologiczne
W obszarze neurologii kanałopatie obejmują m.in. różne formy padaczki, ataksje, migrenę hemiplegiczną, napadową dyskinezę i ból neuropatyczny. Mutacje w kanałach sodowych (np. Naᵥ1.1, Naᵥ1.2) mogą powodować nadmierną pobudliwość neuronów, co sprzyja powstawaniu wyładowań epileptycznych. Z kolei zmiany w kanałach potasowych odpowiedzialnych za repolaryzację mogą utrudniać wygaszanie pobudzeń, wydłużając czas trwania potencjału czynnościowego.
Część kanałopatii dotyczy kanałów wapniowych w neuronach. Zmiany w ich funkcji mogą zaburzać uwalnianie neuroprzekaźników, prowadząc do zaburzeń motorycznych i poznawczych. Kanały jonowe stanowią również kluczowe cele wielu leków przeciwpadaczkowych, przeciwbólowych i psychotropowych. Blokowanie specyficznych kanałów sodowych lub wapniowych może redukować nadmierną pobudliwość, podczas gdy modulacja kanałów potasowych wpływa na hamowanie neuronalne.
Zaburzenia rytmu serca i kanałopatie kardiologiczne
W kardiologii kanałopatie są związane głównie z zaburzeniami rytmu serca. Wrodzone zespoły wydłużonego odstępu QT, zespół Brugada, katecholaminergiczna wielokształtna częstoskurcz komorowa – wszystkie te jednostki chorobowe wynikają z mutacji w genach kodujących kanały sodowe, potasowe lub wapniowe w kardiomiocytach. Zaburzenia te prowadzą do nieprawidłowych sekwencji depolaryzacji i repolaryzacji, co zwiększa ryzyko groźnych arytmii i nagłej śmierci sercowej.
W praktyce klinicznej wiele stosowanych leków antyarytmicznych działa jako blokery określonych kanałów jonowych. Leki klasy I blokują głównie kanały sodowe, klasa III – kanały potasowe. Chociaż pozwala to skutecznie korygować część arytmii, niesie także ryzyko wywołania nowych zaburzeń rytmu, jeśli działanie jest zbyt silne lub nieselektywne. Zrozumienie indywidualnych różnic genetycznych w budowie kanałów staje się więc fundamentem nowoczesnej, spersonalizowanej kardiologii.
Inne kanałopatie i cele terapeutyczne
Zaburzenia funkcjonowania kanałów jonowych występują również w mięśniach szkieletowych (miotonie, okresowe porażenia), w nerkach (zespół Liddle’a, postacie wrodzonych moczówek), w trzustce (zaburzenia wydzielania insuliny) czy w nabłonku dróg oddechowych. W przypadku mukowiscydozy mutacje w kanale chlorkowym CFTR prowadzą do zaburzeń transportu jonów i wody, co skutkuje gęstym, lepkim śluzem i przewlekłymi infekcjami płuc.
Z klinicznego punktu widzenia kanały jonowe stały się niezwykle istotnymi celami terapeutycznymi. Leki przeciwnadciśnieniowe, takie jak blokery kanałów wapniowych, zmniejszają napięcie mięśniówki naczyń i obniżają ciśnienie krwi. Leki przeciwarytmiczne, przeciwpadaczkowe, przeciwbólowe, a nawet część leków przeciwcukrzycowych i diuretyków działa poprzez modulację określonych kanałów. Równocześnie toksyny wytwarzane przez zwierzęta (np. jady węży, pająków, stożków morskich) często są wysoce selektywnymi modulatorami kanałów, co czyni je cennymi narzędziami badawczymi i potencjalnymi prototypami nowych leków.
Rozwój metod biologii strukturalnej, takich jak krioelektronowa mikroskopia czy krystalografia rentgenowska, umożliwił uzyskanie trójwymiarowych modeli wielu kanałów jonowych z rozdzielczością atomową. Pozwala to projektować cząsteczki leków o wysokiej swoistości, przewidywać skutki mutacji oraz tworzyć komputerowe modele przewodnictwa jonowego. Kanały jonowe stanowią zatem nie tylko fundamentalny element fizjologii, ale także jeden z najważniejszych obszarów współczesnej farmakologii i medycyny translacyjnej.
FAQ – najczęściej zadawane pytania o kanały jonowe
Czym kanał jonowy różni się od pompy jonowej?
Kanał jonowy tworzy por w błonie i umożliwia bierny przepływ jonów zgodnie z ich gradientem elektrochemicznym, bez bezpośredniego zużycia ATP. Działa bardzo szybko, przewodząc ogromne ilości jonów w krótkim czasie. Pompa jonowa natomiast aktywnie transportuje jony wbrew gradientowi, wykorzystując energię z hydrolizy ATP, przez co jest wolniejsza, ale kluczowa dla utrzymania długotrwałych różnic stężeń jonów po obu stronach błony.
Dlaczego selektywność kanałów jonowych jest tak ważna?
Selektywność zapewnia, że przez dany kanał przechodzą tylko określone jony, co pozwala precyzyjnie kształtować potencjał błonowy i sygnały komórkowe. Gdyby kanały były nieselektywne, komórka straciłaby kontrolę nad składem jonowym i nie mogłaby generować precyzyjnych odpowiedzi na bodźce. Dokładne rozróżnianie Na⁺, K⁺, Ca²⁺ czy Cl⁻ umożliwia równoczesne współistnienie wielu szlaków sygnalizacyjnych i zachowanie stabilności środowiska wewnętrznego.
Jak badane są kanały jonowe w laboratorium?
Najważniejszą metodą jest technika patch-clamp, pozwalająca mierzyć prądy jonowe przepływające przez pojedyncze kanały lub całą błonę komórkową. Łączy się ją z manipulacjami genetycznymi, aby analizować wpływ mutacji, oraz z farmakologią, testując działanie leków i toksyn. Coraz częściej wykorzystuje się też krio-EM do poznawania struktury kanałów oraz modelowanie komputerowe, które symuluje ruch jonów i dynamikę białka w warunkach zbliżonych do fizjologicznych.