Akwaporyny to niewielkie białka błonowe, które odmieniły sposób, w jaki biologia postrzega transport wody przez komórki. Ich odkrycie wyjaśniło, dlaczego woda może przemieszczać się niezwykle szybko i selektywnie przez błony biologiczne, mimo że sama dwuwarstwa lipidowa działa jak bariera. Zrozumienie budowy i funkcji akwaporyn jest kluczowe dla poznania pracy nerek, mózgu, gruczołów wydzielniczych, a także mechanizmów odporności roślin i zjawisk tak podstawowych, jak utrzymanie objętości komórki oraz równowaga wodno-elektrolitowa organizmu.
Budowa i rodzaje akwaporyn
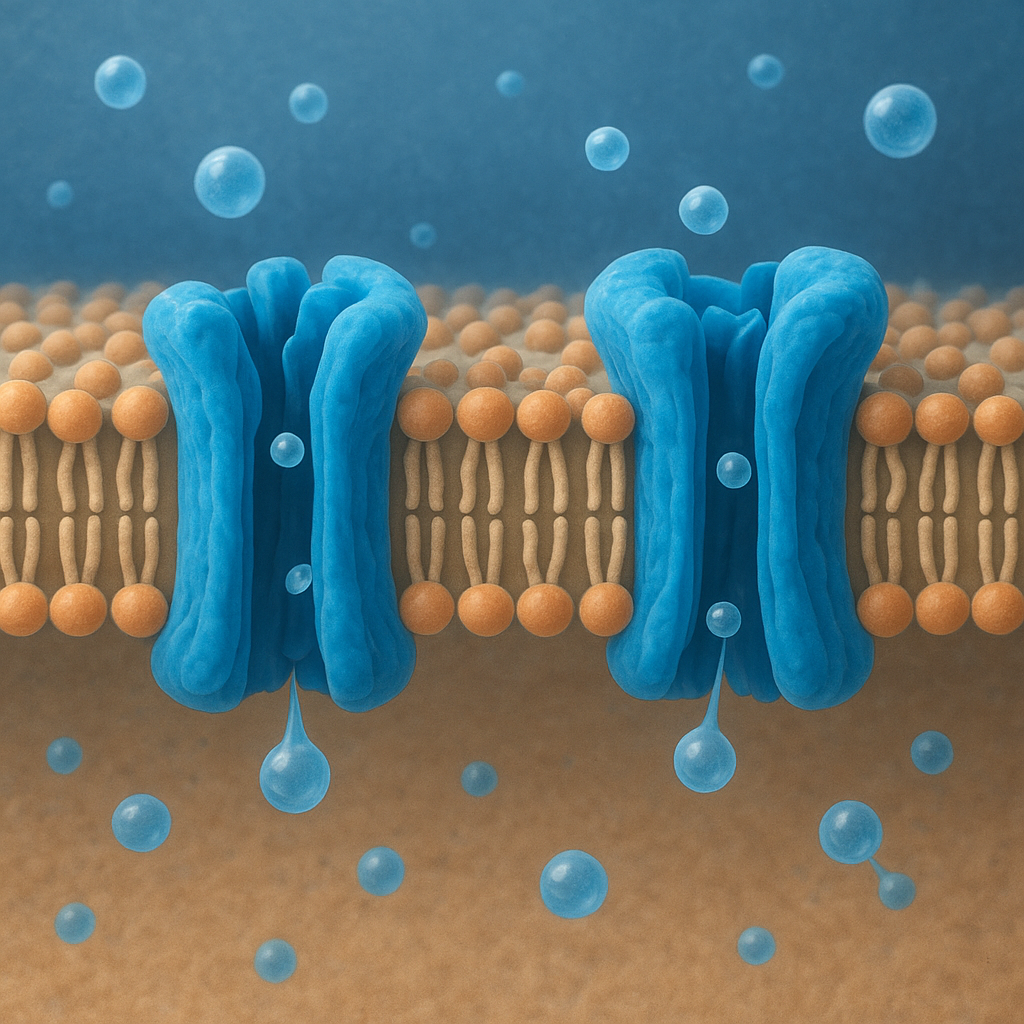
Akwaporyny należą do rodziny białek zwanych kanałami wodnymi. Są to białka integralne błony komórkowej, co oznacza, że przechodzą przez całą jej grubość. Pojedyncza cząsteczka akwaporyny zbudowana jest z około 250–300 aminokwasów, tworzących charakterystyczną strukturę obejmującą sześć odcinków przezbłonowych (helis alfa). Układają się one tak, aby w środku powstał wąski por, którym poruszają się cząsteczki wody.
Najbardziej charakterystycznym motywem sekwencji akwaporyn są dwa powtarzające się fragmenty aminokwasów: NPA (asparagina–prolina–alanina). Występują one w dwóch pętlach białka, które wnikają do wnętrza błony z przeciwległych stron, a następnie stykają się pośrodku, tworząc swoisty „zwężony filtr”. Ten motyw odgrywa kluczową rolę w selektywności kanału, uniemożliwiając przedostawanie się jonów i protonów, a dopuszczając przejście wyłącznie cząsteczek wody lub – w przypadku niektórych odmian – także niewielkich, obojętnych cząsteczek.
Akwaporyny tworzą w błonie nie pojedyncze, lecz najczęściej cztero-cząsteczkowe zespoły. Tetramek składa się z czterech identycznych podjednostek, z których każda stanowi osobny kanał wodny. Oznacza to, że jeden kompleks białkowy zapewnia aż cztery niezależne drogi przepływu wody. Taki układ zwiększa wydajność transportu i stabilizuje białko w błonie. Można wyobrazić to sobie jak węzeł drogowy z czterema równoległymi tunelami, z których każdy obsługuje oddzielny strumień ruchu.
Choć wszystkie akwaporyny są ze sobą spokrewnione, istnieje wiele ich typów, różniących się nieco budową i właściwościami funkcjonalnymi. U człowieka opisano kilkanaście różnych akwaporyn, oznaczonych skrótem AQP i kolejnym numerem, np. AQP1, AQP2, AQP4. Można je podzielić na dwie główne grupy:
- akwaporyny „klasyczne” – transportują głównie cząsteczki wody;
- akwaporyny rozszerzone (tzw. akwaduktory lub akwagliceroporiny) – oprócz wody przepuszczają także małe cząsteczki obojętne, np. glicerol, mocznik czy niektóre metabolity.
W roślinach różnorodność akwaporyn jest jeszcze większa. Wyróżnia się kilka rodzin, takich jak PIP, TIP, NIP czy SIP, z których każda jest wyspecjalizowana w pracy w innym przedziale komórkowym: błonie plazmatycznej, tonoplaście (błonie wakuoli), błonach plastydów lub aparatu Golgiego. Tak rozbudowana sieć kanałów wodnych pozwala roślinom szybko regulować zawartość wody w różnych częściach komórki, co ma fundamentalne znaczenie przy zmianach wilgotności podłoża i powietrza.
W obrębie jednej komórki może działać równocześnie kilka typów akwaporyn, a ich aktywność jest precyzyjnie regulowana. Czasem odbywa się to poprzez fosforylację określonych reszt aminokwasowych, czasem przez kontrolę liczby białek wbudowanych w błonę. Dzięki temu komórka jest w stanie dynamicznie dostosowywać tempo przepływu wody do aktualnych potrzeb fizjologicznych.
Mechanizm transportu wody i selektywność akwaporyn
Podstawą działania akwaporyn jest osmoza – zjawisko spontanicznego przepływu cząsteczek wody przez półprzepuszczalną błonę z obszaru o niższym stężeniu substancji rozpuszczonych do obszaru o wyższym stężeniu. Dwuwarstwa lipidowa sama w sobie jest dla wody częściowo przepuszczalna, jednak proces ten jest powolny i mało wydajny. Akwaporyny dramatycznie przyspieszają transport, umożliwiając przejście nawet kilkuset milionów cząsteczek wody na sekundę przez pojedynczy kanał.
Struktura poru akwaporyny jest precyzyjnie dopasowana do rozmiaru i właściwości cząsteczki wody. Średnica kanału w jego najwęższym miejscu sięga około 2,8 angstrema, co praktycznie uniemożliwia przejście większym cząsteczkom oraz większości jonów. Wzdłuż poru ułożone są reszty aminokwasowe tworzące sieć oddziaływań elektrostatycznych i wiązań wodorowych, które „ustawiają” cząsteczki wody w określonej orientacji i prowadzą je jak po szynie.
Jednym z najważniejszych wyzwań dla komórki jest zapobieganie niekontrolowanemu transportowi protonów (jonów H+) przez kanał wodny. Gdyby protony mogły swobodnie przemieszczać się wraz z wodą, doszłoby do szybkiego zniszczenia gradientów elektrochemicznych niezbędnych do syntezy ATP i przewodzenia impulsów nerwowych. Akwaporyny rozwiązują ten problem poprzez specjalną geometrię i ładunek wnętrza kanału. Motyw NPA oraz dodatnio naładowane reszty aminokwasowe wymuszają odwrócenie orientacji cząsteczek wody w środku poru, przerywając tzw. „mostek protonowy” i uniemożliwiając transport H+ metodą skoków Grotthussa.
Oprócz filtracji protonów, akwaporyny wykazują także selektywność względem jonów takich jak Na+, K+, Ca2+, Cl-. Ich ładunki i rozmiary są niezgodne z profilem energetycznym wnętrza kanału, przez co ich przenikanie jest niekorzystne termodynamicznie. Kanał preferuje cząsteczki neutralne, niewielkie i zdolne do tworzenia wiązań wodorowych w określonym układzie przestrzennym. Tym sposobem akwaporyny działają jak wysoce wyspecjalizowane „filtry molekularne” dostosowane głównie do transportu wody.
W przypadku akwagliceroporyn kanał jest nieco szerszy i inaczej wyłożony resztami aminokwasów, co pozwala na przenikanie drobnych cząsteczek organicznych, przede wszystkim glicerolu. Białka te występują m.in. w komórkach tłuszczowych i wątrobie, gdzie glicerol jest ważnym substratem w przemianach lipidów i glukoneogenezie. W niektórych organizmach akwagliceroporyny umożliwiają także transport mocznika, arsenianów czy krzemianów, co może mieć znaczenie zarówno dla metabolizmu, jak i dla toksykologii.
Napędzającym siłą transportu przez akwaporyny jest zawsze różnica potencjału chemicznego wody po obu stronach błony – najczęściej różnica ciśnienia osmotycznego. Akwaporyny same nie zużywają energii ATP, lecz umożliwiają szybkie dążenie układu do równowagi. Co ważne, komórka może kontrolować ten proces nie poprzez zmianę kierunku przepływu (ten jest determinowany gradientem), ale poprzez regulację liczby aktywnych kanałów w błonie.
Regulacja ta ma często charakter bardzo dynamiczny. Przykładowo, w komórkach cewek zbiorczych nerki ssaków liczba akwaporyn w błonie zależy od stężenia hormonu wazopresyny. Gdy organizm wymaga oszczędzania wody, wazopresyna wiąże się z receptorami, uruchamia kaskadę sygnałową i powoduje gwałtowne wbudowanie pęcherzyków zawierających akwaporyny w błonę luminalną. Ilość kanałów wodnych rośnie, a przepuszczalność dla wody wyraźnie się zwiększa. Po obniżeniu poziomu hormonu część białek zostaje ponownie zinternalizowana i zdegradowana lub zmagazynowana.
Znaczenie fizjologiczne i kliniczne akwaporyn u człowieka
Akwaporyny są szeroko rozpowszechnione w organizmach żywych, ale szczególnie ważną rolę odgrywają w fizjologii człowieka. Poszczególne typy akwaporyn mają odmienną lokalizację tkankową i specjalizację funkcjonalną. To sprawia, że zaburzenia ich ekspresji lub struktury mogą prowadzić do konkretnych chorób, a wiedza o nich znajduje zastosowanie w medycynie, farmakologii oraz diagnostyce.
AQP1 występuje głównie w śródbłonku naczyń włosowatych, w tym w kłębuszkach nerkowych, a także w nabłonku splotu naczyniówkowego w mózgu oraz w erytrocytach. Odpowiada za szybki transport wody między krwią a otaczającymi tkankami, co jest kluczowe dla filtracji w kłębuszkach, tworzenia płynu mózgowo-rdzeniowego oraz utrzymywania elastyczności krwinek czerwonych podczas przechodzenia przez wąskie kapilary. U ludzi z mutacjami w genie AQP1 zaobserwowano obniżoną zdolność stężania moczu oraz nietypowe cechy krążeniowe, choć całkowity brak AQP1 jest rzadki.
AQP2 ma kluczowe znaczenie dla gospodarki wodnej organizmu. Zlokalizowana jest w błonie luminalnej komórek cewek zbiorczych nerki i bezpośrednio uczestniczy w zwrotnym wchłanianiu wody z przesączu pierwotnego. Jej aktywność regulowana jest przez hormon antydiuretyczny (wazopresynę). Mutacje w genie AQP2 lub zaburzenia w szlaku sygnałowym prowadzą do schorzenia znanego jako nefrogenna moczówka prosta. Chorzy wydalają ogromne ilości rozcieńczonego moczu i muszą stale uzupełniać wodę, aby uniknąć odwodnienia. Badania nad AQP2 doprowadziły do opracowania leków modulujących działanie wazopresyny i leczenia zaburzeń gospodarki wodnej.
AQP3 należy do akwagliceroporyn i znajduje się m.in. w nerkach, jelicie grubym i skórze. Transportuje zarówno wodę, jak i glicerol, co ma znaczenie dla nawilżenia naskórka oraz elastyczności skóry. Zmniejszona ekspresja AQP3 wiązana jest z suchością skóry i zaburzeniami bariery naskórkowej, natomiast nadekspresja obserwowana bywa w niektórych nowotworach. W nerkach AQP3 współuczestniczy w końcowym zagęszczaniu moczu, transportując wodę z komórek nabłonkowych do przestrzeni śródmiąższowej.
AQP4 jest główną akwaporyną ośrodkowego układu nerwowego. Występuje przede wszystkim w stopkach końcowych astrocytów, które otaczają naczynia krwionośne oraz wyściółkę komór mózgu. Tworzy tam gęsto upakowane skupiska nazywane ortogonalnymi tablicami cząsteczek. AQP4 odpowiada za szybkie przenoszenie wody pomiędzy krwią, płynem mózgowo-rdzeniowym a tkanką nerwową. Ma to znaczenie w kształtowaniu obrzęku mózgu, utylizacji płynu śródmózgowego (tzw. układ glimfatyczny) i utrzymaniu homeostazy jonowej.
Z AQP4 wiąże się poważna choroba autoimmunologiczna – neuromyelitis optica (choroba Devica). Organizm wytwarza przeciwciała przeciwko AQP4, co prowadzi do uszkodzenia barier naczyniowych w rdzeniu kręgowym i nerwach wzrokowych, a w konsekwencji do ciężkich zaburzeń neurologicznych i utraty wzroku. Wykrywanie przeciwciał anty-AQP4 jest jednym z kryteriów diagnostycznych tej choroby, a sama akwaporyna stała się ważnym celem terapeutycznym i badawczym.
AQP5 występuje m.in. w gruczołach ślinowych, łzowych oraz w nabłonku dróg oddechowych. Uczestniczy w wytwarzaniu wydzielin bogatych w wodę, takich jak ślina czy łzy. Defekty AQP5 mogą przyczyniać się do suchości błon śluzowych oraz zaburzeń funkcji ochronnych nabłonka oddechowego. Istnieją dane sugerujące, że modulacja aktywności AQP5 może mieć znaczenie w leczeniu niektórych przewlekłych chorób płuc.
Zaburzenia w ekspresji akwaporyn powiązano także z rozwojem licznych nowotworów. Nadmierna ilość AQP1, AQP3 czy AQP5 obserwowana jest m.in. w rakach piersi, jelita grubego, żołądka i płuc. Uważa się, że sprzyja to migracji komórek nowotworowych, angiogenezie oraz tworzeniu przerzutów, ponieważ szybki przepływ wody ułatwia zmianę kształtu i ruchliwość komórek oraz przebudowę macierzy zewnątrzkomórkowej. Akwaporyny stają się w związku z tym potencjalnymi markerami prognostycznymi oraz kandydatami na cele leków przeciwnowotworowych.
Znaczenie kliniczne mają także leki pośrednio wpływające na akwaporyny. Klasycznym przykładem jest furosemid i inne diuretyki pętlowe, które zmieniają gradienty osmotyczne w rdzeniu nerki, co wtórnie wpływa na aktywność AQP2 i innych kanałów wodnych. Nowe generacje leków, tzw. waptany, działają bezpośrednio poprzez modulowanie receptorów wazopresyny i tym samym regulują wbudowywanie AQP2 do błony. Zrozumienie molekularnej biologii akwaporyn pozwala więc projektować bardziej precyzyjne terapie zaburzeń wodno-elektrolitowych.
Akwaporyny w świecie roślin i mikroorganizmów
Akwaporyny odgrywają fundamentalną rolę nie tylko u zwierząt, lecz również u roślin oraz drobnoustrojów. W roślinach są kluczowe dla gospodarki wodnej, która decyduje o turgorze, transporcie soli mineralnych, transpiracji i odporności na suszę. Ich rozmieszczenie w różnych błonach komórkowych tworzy skomplikowaną sieć regulującą ruch wody od korzenia aż po liście.
Rodzina PIP (plasma membrane intrinsic proteins) obejmuje akwaporyny obecne w błonie komórek korzeni, liści oraz łodyg. Biorą one udział w pobieraniu wody z gleby oraz jej przemieszczaniu w kierunku ksylemu. Część PIP otwiera się lub zamyka w odpowiedzi na sygnały środowiskowe, takie jak zasolenie, niedobór wody czy obecność reaktywnych form tlenu. Pozwala to roślinie dynamicznie dopasowywać przepuszczalność błony plazmatycznej do warunków zewnętrznych.
Rodzina TIP (tonoplast intrinsic proteins) groupuje akwaporyny tonoplastu – błony otaczającej wakuolę. Wakuola jest głównym magazynem wody w komórce roślinnej, dlatego kontrola przepływu przez tonoplast ma decydujące znaczenie dla turgoru i wzrostu komórek. Gdy roślina ma dostęp do dużej ilości wody, akwaporyny TIP ułatwiają jej napływ do wakuoli, co prowadzi do rozciągnięcia komórki. W warunkach suszy aktywność tych kanałów może być ograniczana, by zmniejszyć utratę wody z cytoplazmy.
Interesującą grupą są NIP (nodulin-like intrinsic proteins), które oprócz wody mogą transportować także niektóre metaloidy, np. borany czy krzemiany. U roślin wiążących azot, takich jak rośliny strączkowe, NIP biorą udział w wymianie substancji między rośliną a bakteriami brodawkowymi. Dzięki nim możliwe jest przepływanie wody i wybranych rozpuszczalników przez błony symbiotycznych struktur.
Zdolność roślin do przetrwania okresów suszy, zasolenia lub zalania korzeni jest w dużej mierze związana z regulacją ekspresji akwaporyn. Badania pokazują, że w warunkach niedoboru wody niektóre izoformy PIP i TIP ulegają wyciszeniu, podczas gdy inne są indukowane, co pozwala na lepsze gospodarowanie dostępną wodą. Inżynieria genetyczna ukierunkowana na modyfikację akwaporyn jest obecnie jednym z kierunków prac nad roślinami o zwiększonej odporności na stresy abiotyczne.
W świecie mikroorganizmów akwaporyny także pełnią istotne funkcje. U bakterii białka te biorą udział w regulacji objętości komórki, odpowiedzi na nagłe zmiany osmotyczne oraz w transporcie glicerolu i innych związków niezbędnych do metabolizmu. W drożdżach akwagliceroporyny są kluczowe dla fermentacji i regulacji zawartości wody podczas wzrostu w środowiskach o zmiennym stężeniu cukrów. Zrozumienie ich funkcji wykorzystywane jest w biotechnologii, np. przy projektowaniu szczepów lepiej przystosowanych do wysokich stężeń etanolu.
Niektóre pasożyty i patogeny roślin oraz zwierząt wykorzystują akwaporyny do adaptacji do warunków panujących w organizmie gospodarza. Przykładowo, pierwotniaki z rodzaju Plasmodium, wywołujące malarię, posiadają własne kanały wodne i glicerolowe, uczestniczące w regulacji ciśnienia osmotycznego w zakażonych erytrocytach. Białka te stały się potencjalnymi celami nowych leków przeciwpasożytniczych, które miałyby zaburzać gospodarkę wodną patogenu bez uszkadzania komórek gospodarza.
W kontekście globalnych wyzwań, takich jak zmiany klimatu, akwaporyny roślinne i mikrobiologiczne zyskują dodatkowe znaczenie aplikacyjne. Zrozumienie, jak kanały wodne reagują na suszę, zasolenie czy podwyższoną temperaturę, może pomóc w projektowaniu upraw o mniejszym zapotrzebowaniu na wodę oraz szczepów mikroorganizmów odpornych na skrajne warunki. W ten sposób badania nad akwaporynami łączą klasyczną biologię komórki z rolnictwem, ekologią i biotechnologią przemysłową.
Perspektywy zastosowań technologicznych i badawczych
Akwaporyny, dzięki swojej niezwykłej selektywności i wydajności, stały się inspiracją dla inżynierii materiałowej oraz technologii membranowych. Jednym z najbardziej obiecujących kierunków jest wykorzystanie białek kanałowych w nowoczesnych systemach odsalania wody morskiej i oczyszczania ścieków. Membrany zawierające wbudowane akwaporyny mogą potencjalnie przewyższać klasyczne membrany polimerowe pod względem przepuszczalności przy zachowaniu wysokiej zdolności do zatrzymywania soli i zanieczyszczeń.
Tworzenie tzw. biomimetycznych membran opiera się na stabilnym wbudowaniu akwaporyn w sztuczne układy lipidowe lub polimerowe, a następnie na utrwaleniu tak powstałych struktur w nośniku o odpowiednich właściwościach mechanicznych. Wyzwanie polega na zapewnieniu trwałości białek w warunkach technicznych (zmienne pH, temperatura, obecność detergentów) oraz na masowym, tanim wytwarzaniu funkcjonalnych kanałów. Mimo tych trudności, prototypy membran akwaporynowych są już testowane w instalacjach pilotażowych, a ich rozwój może znacząco obniżyć koszty produkcji wody pitnej w regionach dotkniętych deficytem zasobów wodnych.
W biologii strukturalnej akwaporyny stały się modelowymi białkami do badań nad relacją między strukturą a funkcją kanałów błonowych. Krystalizacja AQP1 i innych izoform pozwoliła na uzyskanie obrazów o wysokiej rozdzielczości, co zrewolucjonizowało wiedzę o mechanizmach selektywnego transportu. Metody takie jak krio-EM, dyfrakcja promieniowania X i symulacje dynamiki molekularnej umożliwiają śledzenie ruchu pojedynczych cząsteczek wody wewnątrz poru. Dzięki temu akwaporyny stały się jednym z najlepiej poznanych systemów doświadczalnych do testowania modeli fizykochemicznych przepływu przez kanały nanometryczne.
W medycynie trwają intensywne prace nad opracowaniem selektywnych modulatorów akwaporyn – zarówno inhibitorów, jak i aktywatorów. Blokowanie określonych akwaporyn mogłoby znaleźć zastosowanie w leczeniu obrzęków mózgu, obrzęków nowotworowych czy nadmiernego wydzielania płynów w drogach oddechowych. Z kolei nasilenie aktywności niektórych kanałów wodnych mogłoby być korzystne w zaburzeniach wydzielania łez, śliny lub w chorobach skóry. Jednym z wyzwań jest tu uzyskanie wysokiej specyficzności, aby lek oddziaływał tylko na wybrany typ akwaporyny, bez wywoływania działań niepożądanych w innych tkankach.
Akwaporyny stanowią także narzędzie w biologii syntetycznej. Wbudowując geny kodujące kanały wodne do komórek drobnoustrojów, można regulować ich odporność na stres osmotyczny, efektywność fermentacji lub zdolność do transportu określonych metabolitów. W połączeniu z innymi elementami, takimi jak pompy jonowe i transportery, umożliwia to projektowanie komórek „na zamówienie”, dostosowanych do specyficznych zadań produkcyjnych czy środowiskowych.
Wreszcie, zrozumienie funkcji akwaporyn ma znaczenie dla nauk podstawowych, takich jak fizjologia komórki, neurobiologia, nefrologia czy botanika. Białka te stanowią klasyczny przykład, jak jedno odkrycie może połączyć różne dziedziny nauki – od biochemii i krystalografii, przez medycynę kliniczną, aż po inżynierię środowiska. Ich badanie ilustruje też, jak błona komórkowa, często postrzegana kiedyś jedynie jako bierna bariera, jest w rzeczywistości złożoną, dynamiczną strukturą kontrolującą każdy aspekt wymiany substancji między komórką a jej otoczeniem.
FAQ – najczęstsze pytania o akwaporyny
Czym dokładnie jest akwaporyna i jak ją odkryto?
Akwaporyna to białko tworzące w błonie komórkowej kanał, którym wyjątkowo szybko przepływa woda. Przez długi czas sądzono, że woda przenika przez błonę wyłącznie dyfuzją przez lipidy. Dopiero obserwacje bardzo szybkiego, regulowanego transportu wody sugerowały istnienie specjalnych kanałów. W latach 80. XX wieku zidentyfikowano białko CHIP28 (później nazwane AQP1), a w 1992 r. potwierdzono jego funkcję kanału wodnego, co zostało nagrodzone Noblem dla Petera Agre.
Dlaczego komórka potrzebuje akwaporyn, skoro woda i tak przechodzi przez błonę?
Dwuwarstwa lipidowa jest półprzepuszczalna dla wody, ale jej przepuszczalność jest ograniczona i niepodlegająca precyzyjnej regulacji. W wielu tkankach, jak nerki czy gruczoły wydzielnicze, konieczne są bardzo szybkie i kontrolowane zmiany zawartości wody. Akwaporyny zwiększają przepuszczalność błony dla wody nawet kilkusetkrotnie i pozwalają komórce regulować ten proces przez kontrolę liczby kanałów w błonie. Bez nich narządy odpowiedzialne za koncentrację moczu, tworzenie śliny czy łez nie funkcjonowałyby prawidłowo.
Czym różnią się akwaporyny „klasyczne” od akwagliceroporyn?
Obie grupy należą do jednej rodziny białek, ale różnią się specyficznością transportu. Akwaporyny klasyczne tworzą bardzo wąskie pory, które przepuszczają niemal wyłącznie cząsteczki wody i wykluczają inne cząsteczki oraz jony. Akwagliceroporyny mają nieco szerszy i inaczej ukształtowany kanał, dzięki czemu pozwalają na przechodzenie wody i małych cząsteczek obojętnych, takich jak glicerol czy mocznik. Ta różnica wynika z odmiennych reszt aminokwasowych budujących filtr selektywny w najwęższym fragmencie poru.
Jakie choroby człowieka są związane z zaburzeniami akwaporyn?
Najlepiej poznanym przykładem jest nefrogenna moczówka prosta, związana z mutacjami w genie AQP2 lub zaburzeniami szlaku wazopresyny. Chorzy wydalają duże ilości moczu i odczuwają silne pragnienie. Innym schorzeniem jest neuromyelitis optica, w której przeciwciała atakują AQP4 w ośrodkowym układzie nerwowym, powodując uszkodzenie rdzenia i nerwów wzrokowych. Zmieniona ekspresja akwaporyn obserwowana jest także w wielu nowotworach oraz w chorobach skóry, płuc i gruczołów wydzielniczych.
Czy akwaporyny można wykorzystać w technologiach oczyszczania wody?
Tak, akwaporyny są intensywnie badane jako elementy biomimetycznych membran filtracyjnych. Ich selektywny, szybki transport wody przy jednoczesnym zatrzymywaniu soli i zanieczyszczeń czyni je idealnym wzorcem dla nowoczesnych systemów odsalania i uzdatniania. W praktyce wykorzystuje się rekombinowane białka wbudowywane w nośniki lipidowe lub polimerowe. Największe wyzwania to długotrwała stabilność białek oraz skala produkcji, ale prototypowe instalacje już działają i pokazują duży potencjał tej technologii.