Przenośniki błonowe są kluczowymi elementami komórek wszystkich organizmów żywych. Bez nich życie w znanej nam formie nie mogłoby istnieć, ponieważ to właśnie one kontrolują przepływ substancji przez błony biologiczne, umożliwiając zachowanie odrębności środowiska wewnętrznego i zewnętrznego. Od działania przenośników zależą procesy tak różne, jak przewodzenie impulsów nerwowych, pobieranie składników odżywczych przez bakterie, skurcz mięśni, wydzielanie hormonów czy wytwarzanie energii w mitochondriach i chloroplastach.
Podstawy budowy i funkcji przenośników błonowych
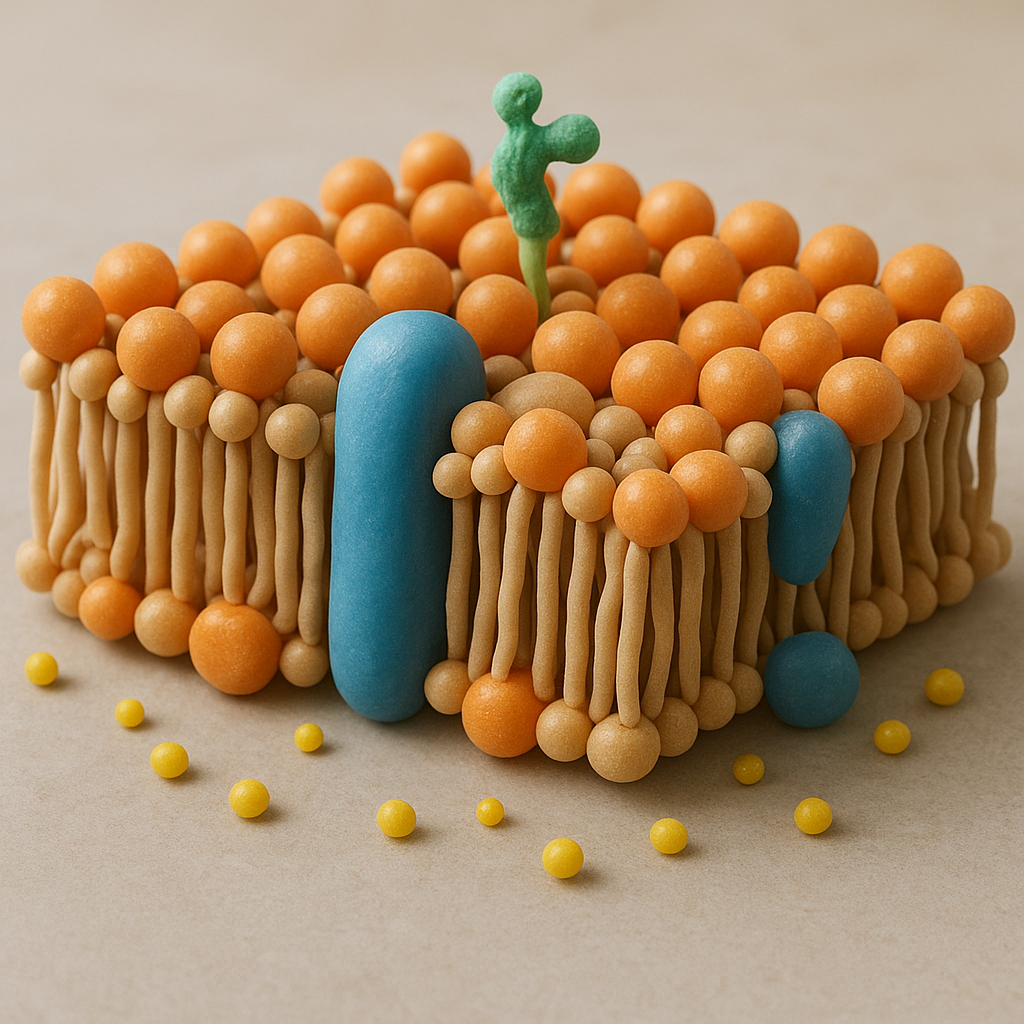
Każda komórka otoczona jest selektywnie przepuszczalną błoną zbudowaną głównie z podwójnej warstwy fosfolipidowej. Ta struktura stanowi barierę dla większości cząsteczek hydrofilowych i jonów, mimo że to właśnie one są niezbędne do procesów życiowych. Dlatego w błonie zakotwiczone są wyspecjalizowane białka – przenośniki, które umożliwiają kontrolowany transport substancji.
W szerszym znaczeniu przenośnikami błonowymi nazywa się wszystkie białka odpowiedzialne za przemieszczanie cząsteczek przez błonę. W węższym, spotykanym w literaturze, rozróżnia się białka kanałowe i tzw. „carriers”; w tym ujęciu przenośniki to szczególny typ białek transportujących, ulegających zmianom konformacji i przenoszących substancje porcjami. Niezależnie od definicji pełnią one rolę regulatorów wymiany między komórką a jej otoczeniem, decydując, jakie związki zostaną pobrane, a jakie usunięte.
Podstawową cechą przenośników jest ich selektywność. Każdy typ białka transportującego rozpoznaje określone jony lub cząsteczki, zwykle o zbliżonej strukturze chemicznej. Dzięki temu glukoza nie konkuruje o to samo białko co aminokwasy, a sód czy potas korzystają z własnych ścieżek. Selektywność wynika z odpowiedniego ukształtowania miejsca wiążącego oraz rozmieszczenia ładunków elektrycznych i reszt hydrofobowych w obrębie białka.
Przenośnik błonowy jest z reguły białkiem integralnym, wielokrotnie przechodzącym przez dwuwarstwę fosfolipidową. Segmenty hydrofobowe zakotwiczają je w błonie, natomiast części hydrofilowe tworzą wewnętrzne kieszenie i kanały, w których może wiązać się transportowana cząsteczka. Zmiany konformacyjne białka umożliwiają naprzemienne „otwieranie się” kieszeni do jednej lub drugiej strony błony.
Rodzaje transportu i klasyfikacja przenośników
Transport przez błonę można opisać z punktu widzenia bilansu energetycznego. Jeśli substancja przemieszcza się zgodnie z gradientem stężenia lub potencjału elektrochemicznego, mówimy o transporcie biernym. Gdy ruch zachodzi wbrew gradientowi, układ musi dostarczyć energii – to transport czynny. Przenośniki błonowe uczestniczą w obu tych typach procesów.
Transport bierny: ułatwiona dyfuzja
Ułatwiona dyfuzja to przemieszczanie cząsteczek zgodnie z ich gradientem stężenia, ale przy udziale białek transportujących. Przykładem są transportery glukozy z rodziny GLUT. Glukoza sama nie przenika łatwo przez hydrofobowe wnętrze błony, lecz wiąże się z przenośnikiem, który zmienia konformację i uwalnia cząsteczkę po drugiej stronie.
Charakterystyczną cechą przenośników biernych jest możliwość wysycenia – po osiągnięciu pewnego stężenia substratu szybkość transportu nie rośnie dalej, ponieważ wszystkie cząsteczki białka są zajęte. To odróżnia transport pośredniczony przez białka od zwykłej dyfuzji, która rośnie liniowo ze wzrostem gradientu.
Transport czynny pierwotny
W transporcie czynnym pierwotnym energia pochodzi bezpośrednio z hydrolizy ATP lub innego nośnika energii chemicznej. Klasycznym przykładem jest pompa sodowo‑potasowa (Na⁺/K⁺‑ATPaza), która usuwa z komórki jony sodu, a wprowadza jony potasu, utrzymując elektrochemiczny gradient potrzebny m.in. do przewodzenia impulsów nerwowych i regulacji objętości komórki.
Przenośniki tego typu należą do grupy pomp ATP‑zależnych. Wymagają przyłączenia cząsteczki ATP do specyficznej domeny białka i jej hydrolizy, co wywołuje konformacyjną zmianę struktury. Następstwem jest translokacja jonów przez błonę oraz ich uwolnienie po przeciwnej stronie. Działanie pomp jest ściśle ukierunkowane – pozwala budować i utrzymywać różnice stężeń rzędu kilku rzędów wielkości.
Transport czynny wtórny
Transport czynny wtórny nie korzysta bezpośrednio z ATP. Energię czerpie z istniejącego gradientu określonego jonu, najczęściej sodu lub protonów. Przenośniki sprzęgające dwa strumienie substancji mogą działać jako symportery (oba substraty przemieszczają się w tym samym kierunku) lub antyportery (w przeciwnych kierunkach).
Przykładem jest symporter sodowo‑glukozowy w nabłonku jelitowym. Energia zgromadzona w gradiencie Na⁺, wytworzonym przez pompę sodowo‑potasową, napędza pobieranie glukozy nawet wbrew jej gradientowi stężenia. W analogiczny sposób działają liczne transportery aminokwasów czy jonów nieorganicznych, istotne w nerkach, jelitach, roślinnych tkankach przewodzących i wielu innych układach.
Klasy białek transportujących
Strukturalnie i funkcjonalnie przenośniki błonowe można podzielić na kilka głównych rodzin:
- białka kanałowe – tworzą hydrofilowe pory, przez które szybko przemieszczają się jony lub małe cząsteczki; przepływ jest zwykle pasywny, sterowany otwieraniem i zamykaniem kanału,
- transportery typu carrier – klasyczne przenośniki, wiążące substrat i poddające się cyklicznym zmianom konformacji; ich praca przypomina „obrócenie klamki” od strony zewnętrznej do wewnętrznej,
- pompy ATP‑zależne – wykorzystują hydrolizę ATP do aktywnego przemieszczania jonów lub innych związków; obejmują rodziny P‑type, V‑type, F‑type i ABC,
- transportery ABC (ATP‑Binding Cassette) – bardzo rozbudowana grupa białek obecnych we wszystkich domenach życia, uczestniczących m.in. w transporcie leków, lipidów czy metabolitów.
W praktyce termin przenośnik bywa stosowany wymiennie z terminem transporter, szczególnie w odniesieniu do białek typu carrier i ABC. Istotniejsze od nazewnictwa jest zrozumienie, jak łączą się one w sieci procesów warunkujących homeostazę komórki.
Mechanizmy działania na poziomie molekularnym
Choć poszczególne przenośniki przenoszą różne substancje i mogą mieć odmienne rozmiary oraz budowę, ich działanie opiera się na kilku ogólnych zasadach fizykochemicznych. Należą do nich: specyficzne wiązanie ligandu, przełączanie się pomiędzy stanami konformacyjnymi, koordynacja z dostarczaniem lub zużyciem energii oraz regulacja przez sygnały komórkowe.
Wiązanie substratu i selektywność
Wnętrze przenośnika tworzy wyspecjalizowaną kieszeń wiążącą. Ułożenie atomów w tym miejscu przypomina trójwymiarową matrycę dopasowaną do kształtu i właściwości chemicznych substratu. Interakcje elektrostatyczne, wiązania wodorowe, oddziaływania van der Waalsa oraz efekty hydrofobowe pozwalają rozróżniać nawet bardzo podobne cząsteczki.
Selektywność ma szczególne znaczenie w przenośnikach jonowych. Kanały potasowe muszą przepuszczać duże ilości K⁺ z prędkością bliską dyfuzji, a jednocześnie odrzucać jony Na⁺, które są mniejsze, ale inaczej uwodnione. Osiąga się to przez odpowiednie ukształtowanie filtra selektywności, umożliwiającego korzystną energetycznie utratę otoczki hydratacyjnej tylko dla wybranego jonu.
Model „zamka obrotowego” i przełączanie stanów
Klasyczny model działania przenośnika zakłada, że białko istnieje w co najmniej dwóch stabilnych konformacjach: otwartej do strony zewnętrznej i otwartej do strony cytoplazmatycznej. Wiązanie substratu stabilizuje jedną z form i nasila prawdopodobieństwo przejścia do drugiej. W efekcie cząsteczka zostaje „przeniesiona” ze swojej strony błony na przeciwną.
Istotne jest, że w typowym cyklu białko nie tworzy jednocześnie ciągłego kanału przez błonę. Dlatego transportowane są zwykle pojedyncze cząsteczki lub niewielkie grupy, a szybkość procesu jest niższa niż w kanałach jonowych. Jednak dzięki temu mechanizmowi przenośniki mogą wykonywać pracę wbrew gradientowi stężeń, ściśle kontrolując, ile cząsteczek zostanie przeniesionych.
Sprzężenie z energią chemiczną i elektrochemiczną
W transporcie czynnym przenośniki muszą przełamywać niekorzystne różnice potencjału elektrochemicznego. Żeby było to możliwe, cykl pracy białka łączy się z procesem dostarczającym energię. W pompach ATP‑zależnych jest to hydroliza ATP; w transporterach wtórnych – „spływanie” jonów zgodnie z ich gradientem.
Wyobraźmy sobie transporter antyportowy, który usuwa z komórki jon A wbrew jego gradientowi, a jednocześnie wprowadza jon B zgodnie z jego gradientem. Całkowita zmiana energii swobodnej obu procesów może być ujemna, jeśli różnica potencjału dla jonu B jest wystarczająco duża. W ten sposób gradienty jednych substancji stają się paliwem dla transportu innych.
Regulacja aktywności przenośników
Komórki muszą dynamicznie dostosowywać intensywność transportu. Aktywność przenośników jest modulowana przez liczne mechanizmy: fosforylację, wiązanie ligandów allosterycznych, zmiany potencjału błonowego, a także przez kontrolę liczby cząsteczek transportera w błonie (endocytoza, egzocytoza, recykling).
Przykładem złożonej regulacji jest odpowiedź komórek mięśniowych i tłuszczowych na insulinę. Hormon ten powoduje szybkie przemieszczenie pęcherzyków zawierających transportery glukozy GLUT4 do błony komórkowej, zwiększając wychwyt glukozy z krwi. Gdy poziom insuliny spada, część transporterów jest ponownie internalizowana, co ogranicza napływ cukru.
Znaczenie przenośników błonowych w fizjologii człowieka
Przenośniki błonowe są niezbędne dla pracy praktycznie wszystkich układów organizmu. Szczególnie istotną rolę odgrywają w układzie nerwowym, mięśniowym, pokarmowym, wydalniczym i dokrewnym. Ich prawidłowe funkcjonowanie decyduje o utrzymaniu równowagi jonowej, odpowiednim poziomie glukozy, właściwej objętości płynów ustrojowych oraz skutecznej komunikacji międzykomórkowej.
Układ nerwowy i przewodzenie impulsów
Neuron spoczynkowy utrzymuje potencjał błonowy około −70 mV dzięki działaniu pompy sodowo‑potasowej i obecności selektywnych kanałów potasowych. Gdy neuron zostaje pobudzony, otwierają się napięciozależne kanały sodowe, umożliwiając gwałtowny napływ Na⁺ i depolaryzację. Następnie aktywują się kanały potasowe przywracające spoczynkowe różnice potencjałów.
Przenośniki i kanały jonowe w neuronach i komórkach glejowych odpowiadają również za utrzymanie odpowiedniego stężenia wapnia, kluczowego dla uwalniania neuroprzekaźników. Zaburzenia w ich działaniu prowadzą do chorób neurologicznych, takich jak padaczka, migreny, ataksje czy niektóre postacie bólu neuropatycznego.
Transport glukozy i metabolizm energetyczny
Glukoza jest podstawowym paliwem większości komórek ssaków, dlatego rodzina transporterów GLUT i symporterów SGLT ma ogromne znaczenie dla metabolizmu. W jelicie cienkim glukoza jest pobierana dzięki sprzężonemu z sodem przenośnikowi SGLT1 na szczytowej powierzchni enterocytów, a następnie uwalniana do krwi przez transporter GLUT2 po stronie podstawno‑bocznej.
W mięśniach szkieletowych i tkance tłuszczowej główną rolę odgrywa GLUT4, którego liczba w błonie zależy od sygnału insulinowego. Insulinooporność i cukrzyca typu 2 wiążą się m.in. z upośledzeniem sygnalizacji prowadzącej do translokacji GLUT4. Nadmierne lub niedostateczne działanie przenośników glukozy zaburza równowagę między poborem a zużyciem energii, wpływając na masę ciała, wydolność fizyczną i funkcje narządów.
Rola w nerkach: filtracja i resorpcja
Nerki wykorzystują rozbudowany zestaw przenośników do precyzyjnego kształtowania składu moczu pierwotnego i ostatecznego. W kanalikach nerkowych zachodzi intensywny transport sodu, potasu, wapnia, fosforanów, glukozy, aminokwasów i licznych metabolitów. Przenośniki, często sprzężone ze sobą w złożone układy, umożliwiają odzyskanie ze światła kanalika prawie wszystkich potrzebnych substancji, pozostawiając w moczu końcowym głównie produkty przemiany materii.
Przykładowo, w kanaliku proksymalnym obecny jest szereg kotransporterów Na⁺/glukoza, Na⁺/aminokwasy i Na⁺/fosforany, natomiast w pętli Henlego pracują symportery Na⁺‑K⁺‑2Cl⁻ oraz transportery potasu i magnezu. Ich funkcja stanowi cel działania wielu leków moczopędnych, a mutacje w genach odpowiednich białek prowadzą do dziedzicznych zaburzeń gospodarki wodno‑elektrolitowej.
Przenośniki w barierach biologicznych
Niektóre tkanki muszą tworzyć bariery szczególnie szczelne, jak bariera krew‑mózg czy nabłonek jelita. W takich miejscach przenośniki błonowe decydują, które substancje zostaną przepuszczone, a które aktywnie usuwane. W komórkach śródbłonka mózgu liczne transportery ABC wypompowują związkidające się do błony, w tym wiele leków, ograniczając ich penetrację do ośrodkowego układu nerwowego.
Analogiczne mechanizmy działają w łożysku, gdzie przenośniki wspomagają selektywne przenikanie składników odżywczych do krwi płodu, a jednocześnie stanowią barierę dla części substancji toksycznych. Harmonijne współdziałanie transporterów w takich strukturach ma kluczowe znaczenie dla rozwoju embrionalnego oraz ochrony mózgu przed szkodliwymi czynnikami.
Przenośniki błonowe w świecie roślin, bakterii i mitochondriów
Choć fizjologia człowieka stanowi naturalny punkt odniesienia, przenośniki błonowe są uniwersalnym narzędziem wykorzystywanym przez wszystkie organizmy. W roślinach kontrolują transport jonów i cukrów pomiędzy organami, u bakterii warunkują pobieranie składników odżywczych i oporność na antybiotyki, zaś w mitochondriach i chloroplastach zarządzają przepływem energii.
Transport w komórkach roślinnych
Rośliny, ze względu na osiadły tryb życia, muszą szczególnie sprawnie gospodarować solami mineralnymi i wodą. W korzeniach liczne przenośniki jonowe pobierają kationy i aniony z roztworu glebowego, niekiedy w silnie niekorzystnych warunkach osmolarności i pH. Pompy protonowe w błonach plazmolemy i tonoplastu (błony wakuoli) tworzą gradienty H⁺, które napędzają wtórny transport kationów i anionów.
W liściach i łodygach przenośniki uczestniczą w załadunku i rozładunku floemu, czyli tkanki przewodzącej produkty fotosyntezy. Skomplikowany system symporterów H⁺/cukry umożliwia transport sacharozy ze źródeł (liści) do tkanek magazynujących, nasion i rozwijających się organów. Zaburzenia działania tych przenośników wpływają na plonowanie roślin, odporność na stres solny i suszę.
Bakterie i antybiotykooporność
U drobnoustrojów przenośniki błonowe pełnią funkcje nie tylko odżywcze, ale także obronne. Transportery ABC i tzw. pompy wypływu (efflux pumps) aktywnie usuwają z komórki toksyny, w tym liczne antybiotyki. Dzięki nim bakterie mogą wykazywać wielolekową oporność, nawet jeśli nie modyfikują bezpośrednio cząsteczki leku ani nie zmieniają jego miejsca docelowego.
Przenośniki pobierające specjalistyczne składniki, takie jak siderofory z wiązanym żelazem, witaminy czy rzadkie cukry, zapewniają przewagę w konkurencji o ograniczone zasoby. Bakterie często modulują ekspresję odpowiednich genów transportowych w odpowiedzi na warunki środowiskowe, co pozwala im przetrwać w bardzo zróżnicowanych niszach ekologicznych.
Mitochondria, chloroplasty i przemiana energii
Mitochondria, uważane za „elektrownie” komórki, oraz chloroplasty w komórkach roślinnych zawdzięczają swoją funkcję w dużej mierze przenośnikom. W wewnętrznej błonie mitochondrialnej działają łańcuchy transportu elektronów, które pompują protony do przestrzeni międzybłonowej, tworząc gradient elektrochemiczny. Ten gradient napędza syntazę ATP – wyjątkowy przenośnik‑enzym wykorzystujący przepływ H⁺ do wytwarzania ATP.
W błonach tych organelli znajdują się również liczne przenośniki metabolitów, takie jak translokaza nukleotydów adeninowych (ADP/ATP) czy przenośniki kwasów dwukarboksylowych i trójkarboksylowych. Bez ich skoordynowanego działania utlenianie substratów energetycznych i biosynteza związków organicznych nie mogłyby zachodzić z odpowiednią wydajnością.
Znaczenie medyczne i farmakologiczne przenośników błonowych
Błędy w funkcjonowaniu przenośników błonowych prowadzą do licznych chorób genetycznych i nabytch. Ponadto wiele leków wykorzystuje lub modyfikuje działanie konkretnych transporterów. Dlatego przenośniki stały się ważnym celem badań farmakologicznych, a znajomość ich właściwości jest niezbędna do racjonalnego stosowania leków.
Choroby kanałopatii i transportopatii
Mutacje w genach kodujących kanały i przenośniki jonowe określa się mianem kanałopatii lub szerzej transportopatii. Przykładem jest mukowiscydoza, spowodowana defektem białka CFTR – kanału chlorkowego będącego również transporterem z rodziny ABC. Nieprawidłowy transport Cl⁻ prowadzi do zagęszczenia śluzu w drogach oddechowych i przewodzie pokarmowym, sprzyjając infekcjom i zaburzeniom trawienia.
Innym przykładem jest wrodzona łamliwość kości związana z zaburzeniami transportu jonów w komórkach kostnych, czy dziedziczne zespoły utraty soli przez nerki wynikające z defektów transporterów w pętli Henlego. Choroby te pokazują, jak subtelne zmiany w funkcji pojedynczego przenośnika mogą wywołać szerokie konsekwencje fizjologiczne.
Przenośniki jako cele leków
Liczne leki oddziałują bezpośrednio na przenośniki błonowe. Diuretyki pętlowe hamują symporter Na⁺‑K⁺‑2Cl⁻ w nerce, zwiększając wydalanie jonów i wody. Selektywne inhibitory wychwytu zwrotnego serotoniny blokują transportery tej aminy w synapsach, wydłużając jej działanie w ośrodkowym układzie nerwowym. Inhibitory SGLT2, stosowane w leczeniu cukrzycy, zmniejszają resorpcję glukozy w nerkach.
Równie istotne są interakcje lek–transporter w wątrobie, jelicie i śródbłonku naczyń. Przenośniki takie jak P‑glycoproteina (MDR1) czy BCRP mogą ograniczać biodostępność doustnych farmaceutyków, a ich polimorfizmy genetyczne prowadzą do zróżnicowanej odpowiedzi pacjentów na terapię. Z tego powodu farmakologia transporterów stała się osobnym, intensywnie rozwijającym się działem nauk biomedycznych.
Nowe strategie terapeutyczne
Postęp w biologii strukturalnej i technikach obrazowania na poziomie atomowym umożliwił poznanie trójwymiarowych struktur wielu przenośników. Dzięki temu można projektować cząsteczki precyzyjnie modulujące ich działanie – agonistów, antagonistów, inhibitorów niekompetycyjnych czy modulatorów allosterycznych.
Obiecującym kierunkiem są leki korygujące wadliwe przenośniki w chorobach genetycznych, jak modulatory CFTR w mukowiscydozie. Inne podejścia obejmują hamowanie pomp wielolekowej oporności w komórkach nowotworowych w celu zwiększenia skuteczności chemioterapii oraz wykorzystywanie przenośników do kierowanego dostarczania leków do wybranych tkanek.
FAQ – najczęstsze pytania o przenośniki błonowe
Jak najprościej wyjaśnić, czym jest przenośnik błonowy?
Przenośnik błonowy to białko wbudowane w błonę komórkową, które umożliwia kontrolowane przenoszenie określonych substancji z jednej strony błony na drugą. Działa jak selektywna brama: rozpoznaje wybrane jony lub cząsteczki, wiąże je, a następnie dzięki zmianom kształtu „przerzuca” przez warstwę lipidową. Może działać biernie, zgodnie z gradientem stężeń, lub aktywnie, zużywając energię, aby transportować substancje wbrew temu gradientowi.
Czym różni się kanał jonowy od przenośnika?
Kanał jonowy tworzy w błonie hydrofilowy tunel, przez który jony mogą szybko przepływać zgodnie z gradientem elektrochemicznym. Przepływ jest bardzo wydajny, lecz zwykle wyłącznie bierny. Przenośnik (carrier) wiąże pojedyncze cząsteczki, przechodzi cykl zmian konformacji i uwalnia je po drugiej stronie; jest wolniejszy, ale może wykonywać pracę wbrew gradientowi, jeśli jest sprzężony z dostarczaniem energii. Kanały przypominają otwieraną furtkę, a przenośniki – ruchomą windę przewożącą ładunek.
Dlaczego przenośniki błonowe są tak ważne dla zdrowia?
Od działania przenośników zależy poziom jonów, glukozy, aminokwasów i wielu innych cząsteczek zarówno wewnątrz komórek, jak i w płynach ustrojowych. To one utrzymują prawidłowe napięcie mięśni, przewodzenie impulsów nerwowych, funkcję nerek, wchłanianie w jelitach czy wydzielanie hormonów. Mutacje w genach kodujących przenośniki prowadzą do chorób wrodzonych, a ich nabyta dysfunkcja towarzyszy m.in. cukrzycy, nadciśnieniu, niewydolności serca i schorzeniom neurologicznym.
Czy przenośniki błonowe można „wzmocnić” dietą lub suplementami?
Bezpośrednie „wzmacnianie” pojedynczych przenośników za pomocą diety jest ograniczone, bo ich aktywność kontrolują głównie mechanizmy genetyczne i sygnalizacja hormonalna. Prawidłowe odżywianie, odpowiednia podaż elektrolitów, glukozy i aminokwasów oraz unikanie toksyn wspierają ogólną funkcję błon i białek transportujących. W niektórych sytuacjach klinicznych stosuje się suplementację (np. soli mineralnych), by zmniejszyć obciążenie określonych przenośników, ale jest to zawsze działanie ukierunkowane, prowadzone pod kontrolą lekarza.
Jak bada się przenośniki błonowe w laboratorium?
Naukowcy wykorzystują wiele technik: elektrofizjologię (np. patch‑clamp) do pomiaru prądów jonowych, barwne lub radioaktywne markery do śledzenia pobierania substancji, metody biologii molekularnej do manipulowania genami transporterów oraz krystalografię rentgenowską i mikroskopię krioelektronową do poznawania ich struktury. Coraz częściej stosuje się też symulacje komputerowe dynamiki molekularnej. Połączenie tych metod pozwala zrozumieć, jak przenośniki działają na poziomie atomowym i jak można je modulować farmakologicznie.