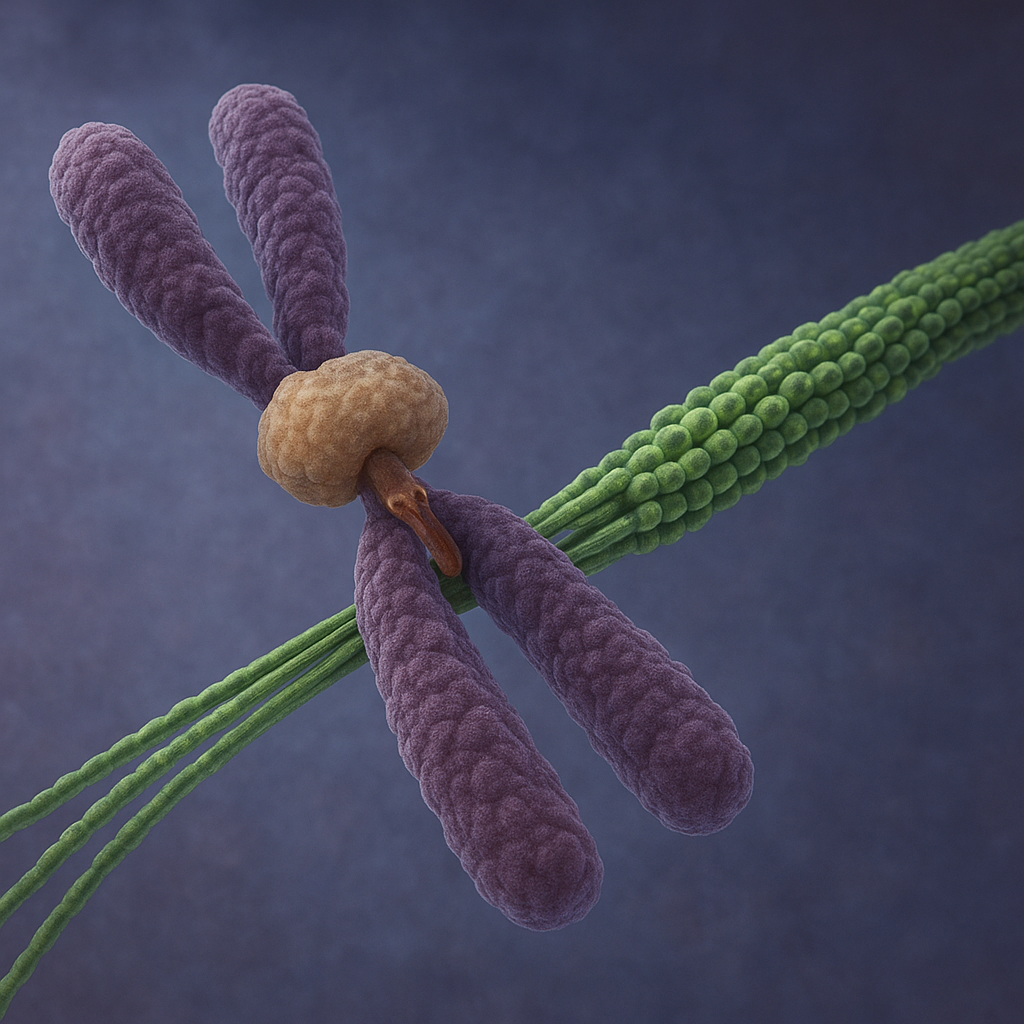
Mikrotubule kinetochorowe stanowią kluczowy element maszynerii podziału komórkowego, zapewniającej równomierne rozdzielenie materiału genetycznego pomiędzy komórki potomne. Zrozumienie ich budowy, funkcji i powiązań z innymi strukturami cytoszkieletu jest niezbędne, aby pojąć, jak komórki utrzymują stabilność genomu, a także co dzieje się, gdy ten delikatny układ ulegnie zaburzeniu. W biologii komórki mikrotubule kinetochorowe są jednym z najlepiej zbadanych, a jednocześnie najbardziej fascynujących przykładów przekształcania energii chemicznej w precyzyjny ruch molekularny.
Budowa mikrotubuli i ich miejsce w cytoszkielecie
Mikrotubule są cylindrycznymi strukturami zbudowanymi z tubuliny, białka występującego w postaci dimerów złożonych z podjednostek α-tubuliny i β-tubuliny. Dimery te spontanicznie polimeryzują, tworząc długie protofilamenty, które łączą się bocznie w rurkę o średnicy około 25 nm. Taka organizacja pozwala mikrotubulom pełnić funkcje zarówno mechaniczne, jak i transportowe, stanowiąc podstawowy element cytoszkieletu komórki eukariotycznej.
Każda mikrotubula jest strukturą spolaryzowaną: posiada koniec plus i koniec minus. Na końcu plus zachodzi zwykle szybka polimeryzacja i depolimeryzacja, natomiast koniec minus jest częściej zakotwiczony w ośrodku organizującym mikrotubule, takim jak centrosom. Taka polaryzacja jest kluczowa dla działania mikrotubuli kinetochorowych, ponieważ kierunek polaryzacji determinuje sposób przyłączania się białek motorycznych oraz orientację sił działających na chromosomy.
W stanie interfazy mikrotubule tworzą dynamiczną sieć, sięgającą od centrosomów ku obwodowym partiom cytoplazmy. Wraz z wejściem komórki w mitozę reorganizują się i formują wrzeciono podziałowe. Część z nich stanie się mikrotubulami biegunowymi, część astralnymi, a część – mikrotubulami kinetochorowymi – bezpośrednio połączy się z chromosomami. Zatem każda mikrotubula kinetochorowa jest wyspecjalizowaną formą ogólnej struktury mikrotubularnej, przystosowaną do interakcji z określonym kompleksem białkowym na chromosomie.
Stabilność mikrotubuli i ich zdolność do dynamicznych zmian zależą od obecności nukleotydu GTP związanego z β-tubuliną. Podczas polimeryzacji do końca plus wbudowywane są dimery tubuliny-GTP, które po pewnym czasie ulegają hydrolizie do GDP. Jeśli na końcu mikrotubuli utrzymuje się tzw. „czapeczka GTP”, struktura jest stabilna; utrata tej czapeczki prowadzi do gwałtownej depolimeryzacji. Mechanizm ten, znany jako niestabilność dynamiczna, jest bezpośrednio wykorzystywany przez mikrotubule kinetochorowe do generowania sił przesuwających chromosomy.
Czym jest mikrotubula kinetochorowa i jak powstaje
Mikrotubula kinetochorowa to mikrotubula wrzeciona podziałowego, której koniec plus jest połączony z kinetochorem – wyspecjalizowaną strukturą białkową zlokalizowaną w obrębie centromeru chromosomu. To właśnie ta mikrotubula odpowiada za mechaniczne połączenie chromosomu z biegunem wrzeciona, a tym samym za przesuwanie i segregację materiału genetycznego podczas mitozy i mejozy.
W początkowych fazach mitozy, w profazie, centrosomy oddalają się od siebie, jednocześnie inicjując intensywną nukleację mikrotubuli. Gdy błona jądrowa zaczyna ulegać fragmentacji, w prometafazie, mikrotubule wrzeciona zyskują dostęp do kondensowanych chromosomów. Nie wszystkie mikrotubule od razu stają się mikrotubulami kinetochorowymi – część z nich wzrasta i kurczy się losowo, aż natrafi na kinetochor. Taki mechanizm poszukiwania i chwytania umożliwia szybkie znalezienie właściwego celu bez konieczności specyficznego kierowania każdą mikrotubulą.
Kinetochor jest wieloskładnikowym kompleksem białkowym, który tworzy się na sekwencjach centromerowych DNA. Wyróżnia się w nim warstwę wewnętrzną, silnie związaną z chromatyną, oraz warstwę zewnętrzną, odpowiedzialną za interakcję z mikrotubulami. To właśnie w warstwie zewnętrznej znajdują się białka wiążące tubulinę i modulujące jej dynamikę, umożliwiając tworzenie stabilnego, choć ciągle dynamicznego połączenia między chromosomem a mikrotubulą.
Powstanie mikrotubuli kinetochorowej obejmuje trzy główne etapy. Po pierwsze, mikrotubule wychodzące z centrosomu wyrastają w kierunku przestrzeni, w której znajdują się chromosomy. Po drugie, ich końce plus napotykają kinetochor i wchodzą w interakcję z białkami kompleksu. Początkowo połączenia te są dość luźne i mogą ulegać łatwemu rozerwaniu, co redukuje ryzyko utrwalenia nieprawidłowych przyczepów. Po trzecie, połączenia zostają wzmocnione, jeśli mikrotubule przyczepią się do obu kinetochorów chromosomu w orientacji bioryentalnej – jeden kinetochor ku jednemu biegunowi, drugi ku drugiemu.
W miarę jak rośnie liczba mikrotubuli przyłączonych do pojedynczego kinetochoru, powstaje wiązka mikrotubul kinetochorowych. W komórkach ssaczych jeden kinetochor może wiązać od kilku do kilkunastu mikrotubuli, tworząc stabilny most łączący chromosom z biegunem wrzeciona. Liczba ta zależy od wielkości kinetochoru i specyfiki organizmu, ale ogólna zasada pozostaje podobna: im ważniejsza jest precyzja segregacji, tym więcej redundancji w postaci wielu równolegle ułożonych mikrotubuli.
W tym kontekście mikrotubula kinetochorowa nie jest po prostu „kolejną” mikrotubulą w komórce. Jest to struktura funkcjonalnie wyspecjalizowana, utrzymywana i regulowana przez złożone interakcje z białkami kinetochorowymi, enzymami fosforylującymi i defosforylującymi oraz przez sygnały kontrolne wysyłane z punktu kontrolnego wrzeciona. Dzięki temu każdy chromosom może zostać dokładnie zorientowany i przygotowany do rozdziału.
Rola mikrotubuli kinetochorowych podczas mitozy i mejozy
Mitosę dzieli się na kilka etapów: profazę, prometafazę, metafazę, anafazę i telofazę. Mikrotubule kinetochorowe odgrywają szczególnie istotną rolę od prometafazy do anafazy. W prometafazie, po rozpadzie otoczki jądrowej, mikrotubule zaczynają wychwytywać kinetochory. Proces ten jest dynamiczny: mikrotubule wielokrotnie przyczepiają się i odczepiają, dopóki nie uzyskają poprawnej orientacji – bioryentacji – w której każdy z siostrzanych kinetochorów połączony jest z przeciwległym biegunem wrzeciona.
W metafazie wszystkie chromosomy ustawiają się w płaszczyźnie równikowej komórki, tworząc tzw. płytkę metafazową. Pozycjonowanie to nie jest wynikiem statycznego „przyciągnięcia”, lecz równowagi sił działających z obu biegunów wrzeciona. Mikrotubule kinetochorowe przyłączone do danego chromosomu wydłużają się i skracają w sposób zsynchronizowany, a ich dynamiczność jest odpowiednio modulowana. Dopiero gdy wszystkie chromosomy zostaną prawidłowo zorientowane i naprężone, punkt kontrolny wrzeciona pozwala komórce przejść do anafazy.
W anafazie mikrotubule kinetochorowe odgrywają kluczową rolę w fizycznym rozdzieleniu chromatyd siostrzanych. Po przecięciu kohezyn, które spajają chromatydy, każda z nich staje się niezależnym chromosomem i jest ciągnięta w stronę odpowiedniego bieguna wrzeciona. Mechanizm ruchu obejmuje zarówno depolimeryzację mikrotubuli przy kinetochorze, jak i przy biegunie. Depolimeryzacja ta generuje siłę „ściągającą”, przy czym końce mikrotubuli nadal pozostają związane z kinetochorem dzięki specjalnym kompleksom białkowym, które potrafią śledzić cofający się koniec mikrotubuli.
Podczas mejozy, która prowadzi do powstania komórek rozrodczych, mikrotubule kinetochorowe również są nieodzowne. W mejozie I segregacji ulegają chromosomy homologiczne, a nie siostrzane chromatydy, co wymaga innej organizacji przyczepów mikrotubuli do kinetochorów. Kinetochory chromatyd siostrzanych znajdują się w takim położeniu, że przyłączają się do mikrotubuli prowadzących do tego samego bieguna, podczas gdy kinetochory chromosomów homologicznych są skierowane ku przeciwnym biegunom. Specyficzne białka, obecne tylko w komórkach przechodzących mejozę, modyfikują architekturę kinetochorów, by umożliwić ten unikalny schemat podziału.
W mejozie II, bardziej zbliżonej do klasycznej mitozy, sytuacja ulega zmianie: siostrzane chromatydy muszą zostać rozdzielone, a więc kinetochory muszą przyjąć bioryentalną konfigurację względem biegunów. W obu podziałach mejotycznych mikrotubule kinetochorowe działają jednak na wspólnej zasadzie – łączą chromosomy z biegunami i wykorzystują swą dynamiczną naturę do ich przemieszczania.
Nie można też pominąć roli mikrotubuli kinetochorowych w utrzymaniu prawidłowego napięcia między siostrzanymi kinetochorami. Napięcie to jest sygnałem dla systemu kontroli wrzeciona, że chromosomy są poprawnie przyłączone i gotowe do separacji. Jeśli napięcie jest zbyt małe lub nierównomierne, punkt kontrolny opóźnia przejście do anafazy, dając komórce czas na korektę błędnych przyczepów. Dzięki temu mikrotubule kinetochorowe są nie tylko strukturami mechanicznymi, ale także nośnikami informacji o stanie segregacji chromosomów.
Dynamika mikrotubuli kinetochorowych i mechanizmy generowania siły
Jedną z najciekawszych cech mikrotubuli kinetochorowych jest ich zdolność do generowania ruchu bez klasycznych motorów mięśniowych, takich jak miozyna. Owszem, w kinetochorach obecne są białka motoryczne, w tym kinezyny i dyneiny, ale ogromna część siły koniecznej do przesuwania chromosomów wynika bezpośrednio z depolimeryzacji tubuliny. Podczas skracania mikrotubuli końcowe dimery tubuliny zmieniają konformację, wyginając się na zewnątrz, co może pociągać za sobą przyłączony kinetochor.
Mechanizm ten został dobrze opisany w modelu tzw. „półpierścieni” białek wiążących się z końcem mikrotubuli. Białka te tworzą struktury okalające mikrotubulę, które przesuwają się wraz z depolimeryzującym końcem, utrzymując fizyczny kontakt z kinetochorem. Do takich kompleksów należy m.in. kompleks Ndc80, który wiąże się z boczną powierzchnią mikrotubuli, umożliwiając zarówno połączenie stabilne, jak i przesuwne.
Dynamika mikrotubuli kinetochorowych jest ściśle regulowana przez liczne czynniki. Fosforylacja białek kinetochorowych przez kinazy, takie jak Aurora B, może zmniejszać ich powinowactwo do mikrotubuli, co sprzyja odłączaniu błędnych przyczepów. Z kolei defosforylacja stabilizuje prawidłowe wiązania. W ten sposób komórka wykorzystuje sygnały fosforylacyjne do selekcji tych mikrotubul, które zapewniają symetryczne, naprężone połączenie między chromosomami a biegunami wrzeciona.
Należy również podkreślić rolę białek MAP (microtubule-associated proteins), które mogą stabilizować mikrotubule lub, przeciwnie, promować ich depolimeryzację. Przykładowo, białka z rodziny kinesin-13 działają jako czynniki depolimeryzujące, przyspieszając skracanie mikrotubuli kinetochorowych i tym samym ruch chromosomów w stronę biegunów. Harmonijne współdziałanie tych czynników zapewnia, że ruch jest płynny i zsynchronizowany z innymi procesami mitotycznymi.
Ciekawym aspektem dynamiki mikrotubuli jest zjawisko „przepływu” tubuliny wzdłuż długości mikrotubuli – polimeryzacja może zachodzić na jednym końcu, a depolimeryzacja na drugim. W kontekście wrzeciona podziałowego może to oznaczać, że chromosom przesuwa się wzdłuż mikrotubuli, która jednocześnie jest skracana przy jednym końcu i wydłużana przy drugim. Taki mechanizm pozwala utrzymać określoną długość mikrotubuli przy jednoczesnym ruchu przyczepionych struktur.
Ważne jest też, że mikrotubule kinetochorowe nie działają w izolacji. Ich dynamika jest sprzężona z mikrotubulami biegunowymi i astralnymi, które wpływają na ogólną architekturę wrzeciona. Zmiany długości mikrotubuli kinetochorowych mogą być kompensowane przez odpowiednie regulacje w innych klasach mikrotubuli, utrzymując symetrię i stabilność całej struktury podziałowej.
Znaczenie mikrotubuli kinetochorowych dla stabilności genomu
Prawidłowe funkcjonowanie mikrotubuli kinetochorowych jest absolutnie kluczowe dla utrzymania stabilności genomu. Każdy błąd w ich działaniu może prowadzić do nierównomiernego rozdziału chromosomów, zjawiska znanego jako aneuploidia. Komórka potomna może otrzymać za dużo lub za mało kopii określonego chromosomu, co zaburza równowagę ekspresji genów i może mieć poważne konsekwencje dla losu tej komórki oraz całego organizmu.
Aneuploidia jest jednym z charakterystycznych znaków rozpoznawczych wielu nowotworów. Zmiany liczby chromosomów mogą umożliwiać komórkom unikanie mechanizmów regulacyjnych, zwiększać ich zdolność do proliferacji, a także sprzyjać oporności na terapie. Wiele badań sugeruje, że defekty w białkach kinetochorowych, w regulacji dynamiki mikrotubuli oraz w funkcjonowaniu punktu kontrolnego wrzeciona mogą sprzyjać powstawaniu aneuploidii w komórkach nowotworowych.
Oprócz nowotworów, zaburzenia segregacji chromosomów w komórkach rozrodczych mogą prowadzić do chorób genetycznych u potomstwa. Klasycznym przykładem jest zespół Downa, wynikający z obecności dodatkowej kopii chromosomu 21. Choć przyczyny takiej nondysjunkcji są złożone, błędy w tworzeniu i funkcji mikrotubuli kinetochorowych podczas mejozy odgrywają istotną rolę.
Komórki dysponują jednak rozbudowanymi systemami kontroli, które monitorują właściwe przyłączenie mikrotubuli kinetochorowych i napięcie między kinetochorami. Kompleksy białkowe, takie jak Mad2, BubR1 i inne elementy punktu kontrolnego wrzeciona, wykrywają nieprawidłowe przyczepy i opóźniają wejście w anafazę. W ten sposób komórka ma dodatkową szansę na korektę błędów przed ostatecznym rozdziałem chromatyd.
Niemniej jednak, żaden system nie jest doskonały i pewien poziom błędów pozostaje nieunikniony. Fascynującym obszarem badań jest zrozumienie, dlaczego niektóre komórki i organizmy lepiej radzą sobie z takimi błędami niż inne i jakie strategie ewolucyjne doprowadziły do optymalizacji działania mikrotubuli kinetochorowych. Można przypuszczać, że ich obecna złożoność odzwierciedla długi proces selekcji, w którym nawet niewielkie usprawnienia w dokładności segregacji chromosomów dawały przewagę adaptacyjną.
Współczesna biologia molekularna i mikroskopia wysokiej rozdzielczości pozwalają coraz lepiej śledzić zachowanie mikrotubuli kinetochorowych w żywych komórkach. Oznaczanie tubuliny fluorescencyjnie i stosowanie znaczników białek kinetochorowych umożliwia obserwację dynamicznych zmian w czasie rzeczywistym. Dane te nie tylko pogłębiają naszą wiedzę podstawową, lecz także wskazują potencjalne cele dla nowych leków przeciwnowotworowych.
Mikrotubule kinetochorowe jako cel działania leków i implikacje medyczne
Mikrotubule od dawna są celem klasycznych chemioterapeutyków. Leki takie jak taksany czy alkaloidy barwinka działają poprzez stabilizację lub destabilizację mikrotubuli, co uniemożliwia prawidłowy przebieg mitozy. Zatrzymanie komórek w mitozie prowadzi zwykle do ich śmierci programowanej. Ponieważ komórki nowotworowe dzielą się szybciej niż większość komórek prawidłowych, są na takie zaburzenia szczególnie wrażliwe.
Klasyczne leki antymikrotubularne działają jednak globalnie na wszystkie klasy mikrotubuli, a nie selektywnie na mikrotubule kinetochorowe. To prowadzi do licznych skutków ubocznych, takich jak neuropatie obwodowe czy zaburzenia funkcji szpiku kostnego. Współczesne badania poszukują więc bardziej precyzyjnych strategii, ukierunkowanych na białka specyficzne dla kinetochorów lub na regulatory dynamiki mikrotubuli w obrębie wrzeciona podziałowego.
Potencjalnymi celami terapeutycznymi są kinazy mitotyczne, takie jak Aurora B czy Mps1, które kontrolują stabilność przyczepów mikrotubuli do kinetochorów oraz aktywność punktu kontrolnego wrzeciona. Inhibicja tych kinaz może prowadzić do katastrofalnych błędów w segregacji chromosomów w komórkach nowotworowych i w rezultacie do ich śmierci. Jednak precyzyjne wyważenie dawki i specyficzności jest trudne, by nie zakłócić nadmiernie podziałów w prawidłowych tkankach.
Innym podejściem jest modulacja samych białek kinetochorowych, na przykład kompleksu Ndc80. Drobnocząsteczkowe inhibitory wiążące się do miejsc interakcji z mikrotubulami mogłyby selektywnie rozregulować przyczepy kinetochorowe, uniemożliwiając prawidłowy rozdział chromosomów w komórkach nowotworowych. Takie podejście wciąż jest jednak na wczesnym etapie badań i wymaga głębokiego zrozumienia struktury i dynamiki kompleksów białkowych.
Istotne implikacje medyczne ma również fakt, że mutacje w białkach kinetochorowych i regulatorach mikrotubuli mogą być biomarkerami agresywności nowotworu, jego podatności na leczenie oraz ryzyka nawrotu choroby. Analiza ekspresji i stanu mutacyjnego takich genów może w przyszłości pomóc w doborze indywidualnej terapii, opartej na specyficznych cechach maszynerii podziałowej danej komórki nowotworowej.
Wreszcie, zrozumienie funkcji mikrotubuli kinetochorowych ma znaczenie nie tylko dla onkologii, ale i dla medycyny rozrodu. Lepsze poznanie przyczyn błędów w segregacji chromosomów podczas mejozy może przyczynić się do poprawy metod diagnostycznych w zakresie niepłodności, poronień nawracających czy zaburzeń rozwojowych. Analiza jakości wrzeciona podziałowego i funkcji kinetochorów w oocytach staje się coraz ważniejszym elementem badań nad przyczynami nieprawidłowego rozwoju zarodków.
Perspektywy badawcze i znaczenie mikrotubuli kinetochorowych w nauce
Mikrotubule kinetochorowe pozostają przedmiotem intensywnych badań z kilku powodów. Po pierwsze, są one idealnym modelem do studiowania ogólnych zasad samorganizacji struktur komórkowych. Powstawanie wrzeciona podziałowego z chaotycznie rozmieszczonych mikrotubuli to przykład spontanicznego wyłaniania się uporządkowanej struktury z wielu lokalnych interakcji. Zrozumienie tych procesów może inspirować także dziedziny takie jak fizyka miękkiej materii czy inżynieria systemów złożonych.
Po drugie, mikrotubule kinetochorowe są znakomitym obiektem do badań nad konwersją energii chemicznej w pracę mechaniczną na poziomie molekularnym. Depolimeryzacja tubuliny, działanie białek motorycznych, regulacja przez nukleotydy i fosforylację – wszystko to składa się na niezwykle wyrafinowany system przetwarzania energii. W porównaniu z innymi maszynami molekularnymi, takimi jak rybosomy czy polimerazy DNA, system segregacji chromosomów wyróżnia się dużą skalą i potrzebą zachowania niezwykle wysokiej precyzji.
Po trzecie, badania nad mikrotubulami kinetochorowymi są ściśle powiązane z rozwojem zaawansowanych metod mikroskopii i obrazowania. Mikroskopia superrozdzielcza, mikroskopia sił atomowych, a także techniki jednocząsteczkowe pozwalają obserwować pojedyncze mikrotubule i białka w działaniu. Dzięki temu możemy nie tylko opisywać ogólne schematy, lecz także śledzić zachowanie pojedynczych elementów w czasie rzeczywistym, co otwiera drogę do coraz bardziej precyzyjnych modeli teoretycznych.
Na koniec warto wspomnieć, że mikrotubule kinetochorowe stanowią ważny most między naukami podstawowymi a zastosowaniami praktycznymi. Z jednej strony są obiektem fundamentalnych dociekań nad naturą życia, organizacją komórki i mechanizmami ewolucji. Z drugiej – bezpośrednio inspirują powstawanie nowych terapii przeciwnowotworowych, metod diagnostycznych w genetyce klinicznej i narzędzi do oceny jakości komórek rozrodczych.
W miarę jak biologia molekularna splata się coraz ściślej z informatyką, fizyką i chemią, mikrotubule kinetochorowe stają się także modelem dla projektowania sztucznych systemów o właściwościach samoregulujących i samonaprawczych. Być może przyszłe materiały inteligentne czy systemy nano-robotyczne będą wprost inspirowane sposobem, w jaki te mikroskopijne struktury dbają o wierne kopiowanie informacji genetycznej w każdej dzielącej się komórce.
FAQ – najczęściej zadawane pytania o mikrotubule kinetochorowe
Co to jest mikrotubula kinetochorowa?
Mikrotubula kinetochorowa to mikrotubula wrzeciona podziałowego, której koniec plus łączy się z kinetochorem – kompleksem białkowym na centromerze chromosomu. Tworzy ona fizyczny most między chromosomem a biegunem wrzeciona, umożliwiając jego ustawienie w płytce metafazowej oraz późniejsze przemieszczenie chromatyd siostrzanych do przeciwnych biegunów podczas anafazy, co zapewnia równomierny podział materiału genetycznego.
Jak powstaje połączenie mikrotubuli z kinetochorem?
Po rozpadzie otoczki jądrowej mikrotubule wyrastają z centrosomów w różnych kierunkach, aż ich końce plus natrafią na kinetochory. Początkowo tworzą one nietrwałe przyczepy boczne, które mogą się odłączyć, jeśli orientacja nie jest prawidłowa. Gdy każdy z dwóch siostrzanych kinetochorów połączy się z mikrotubulami prowadzącymi do przeciwnych biegunów, więź zostaje wzmocniona, a powstające napięcie jest sygnałem dla punktu kontrolnego mitozy.
Jaką rolę pełnią mikrotubule kinetochorowe w mitozie?
W mitozie mikrotubule kinetochorowe odpowiadają za ustawienie chromosomów w płytce metafazowej oraz za ich rozdzielenie w anafazie. Dzięki dynamicznemu wydłużaniu i skracaniu regulują położenie chromosomów względem biegunów wrzeciona. Gdy kohezyny łączące chromatydy zostaną przecięte, depolimeryzacja mikrotubuli przy kinetochorach generuje siłę „ściągającą” chromatydy do przeciwnych biegunów, co gwarantuje równomierne rozdzielenie genomu.
Co się dzieje, gdy mikrotubule kinetochorowe działają nieprawidłowo?
Błędy w funkcjonowaniu mikrotubuli kinetochorowych prowadzą do nieprawidłowej segregacji chromosomów, czyli aneuploidii. Komórki potomne mogą otrzymać zbyt wiele lub zbyt mało kopii niektórych chromosomów, co zaburza równowagę ekspresji genów. Takie zmiany sprzyjają transformacji nowotworowej, progresji guza i oporności na leczenie. W komórkach rozrodczych skutkiem są często choroby genetyczne lub obniżona żywotność zarodków.
Dlaczego mikrotubule są ważnym celem leków przeciwnowotworowych?
Komórki nowotworowe dzielą się intensywnie, dlatego są szczególnie wrażliwe na zaburzenia mitozy. Leki antymikrotubularne stabilizują lub destabilizują mikrotubule, uniemożliwiając prawidłowe tworzenie wrzeciona i połączeń kinetochorowych. Prowadzi to do zatrzymania cyklu komórkowego i śmierci komórek. Obecnie trwają prace nad bardziej selektywnymi terapiami, które celują w białka specyficzne dla kinetochorów lub ich regulatorów, by ograniczyć działania niepożądane klasycznych chemioterapeutyków.