Cykl komórkowy stanowi podstawowy mechanizm, dzięki któremu organizmy żywe rosną, odnawiają swoje tkanki i przekazują materiał genetyczny kolejnym pokoleniom komórek. Zrozumienie jego przebiegu ma kluczowe znaczenie dla nauki o nowotworach, rozwoju organizmów, a także dla nowoczesnych terapii medycznych. Każda komórka dzieląca się w sposób kontrolowany musi przejść sekwencję ściśle regulowanych etapów, obejmujących wzrost, podwojenie DNA oraz podział na dwie komórki potomne. Ten uporządkowany proces jest efektem współdziałania wielu białek i szlaków sygnałowych, które czuwają nad dokładnością i bezpieczeństwem każdego podziału.
Struktura i podstawowe fazy cyklu komórkowego
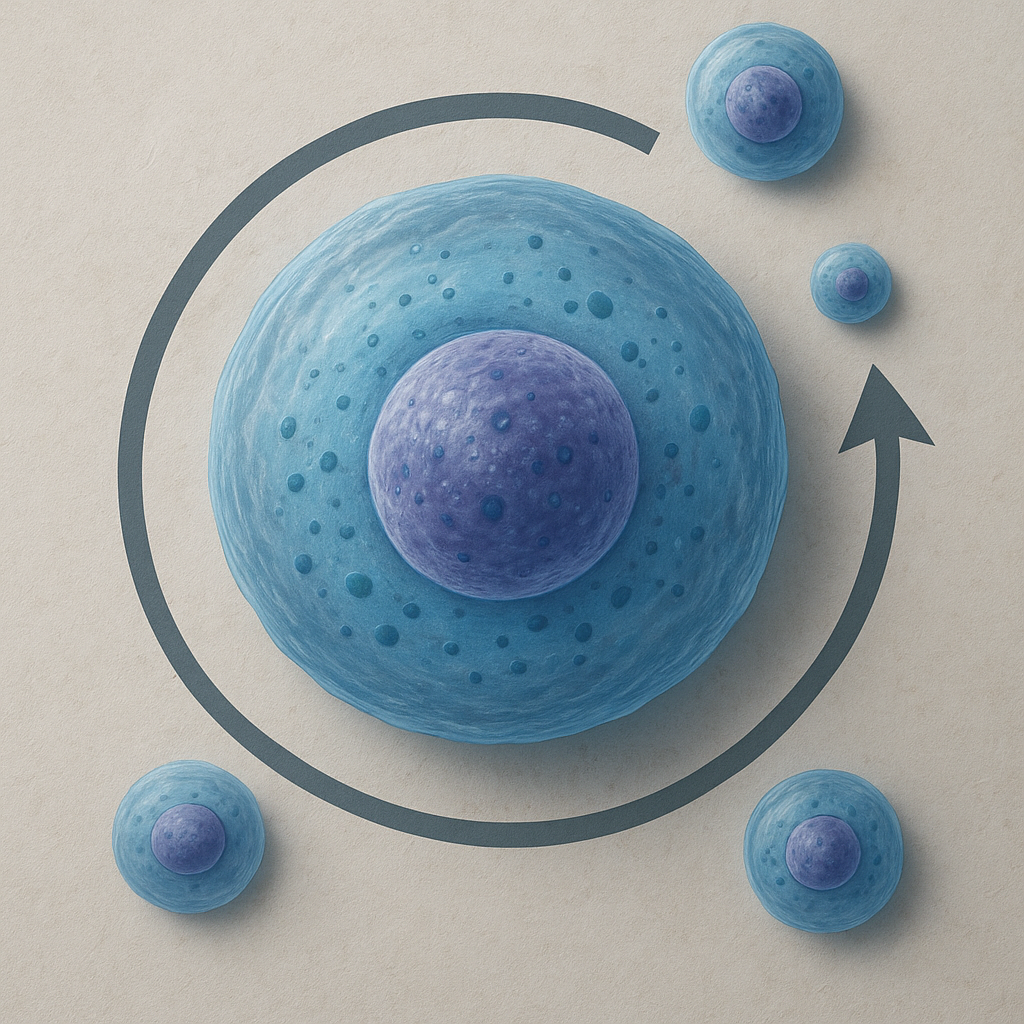
Cykl komórkowy dzieli się na dwie główne części: interfazę oraz fazę M (mitozy i cytokinezy). Interfaza obejmuje większość życia komórki i jest etapem intensywnej aktywności metabolicznej, wzrostu oraz przygotowań do podziału. To w jej trakcie materiał genetyczny jest dokładnie kopiowany, a komórka odbudowuje zasoby niezbędne do podziału. Faza M jest stosunkowo krótka, ale spektakularna: chromosomy ulegają kondensacji, równomiernie rozdzielają się, a następnie cytoplazma zostaje przecięta, tworząc dwie odrębne komórki potomne.
W klasycznym ujęciu wyróżnia się cztery główne fazy cyklu: G1, S, G2 i M. Fazy G1, S i G2 tworzą razem interfazę. W fazie G1 komórka rośnie, syntetyzuje białka i przygotowuje się do replikacji DNA. Faza S to etap, w którym zachodzi replikacja DNA, czyli precyzyjne podwojenie materiału genetycznego. W fazie G2 komórka kończy syntezę białek, kontroluje poprawność skopiowanego DNA i gromadzi energię konieczną do wejścia w mitozę. Wreszcie faza M obejmuje szereg uporządkowanych wydarzeń, prowadzących do równomiernego rozdziału skopiowanego genomu.
Kluczowym aspektem zrozumienia cyklu komórkowego jest pojęcie tzw. fazy G0. To stan spoczynku, w którym znajdują się komórki niepoddające się aktualnie podziałowi. Niektóre, jak neurony w dojrzałym mózgu, przebywają w G0 praktycznie przez całe życie organizmu. Inne, na przykład komórki wątroby, mogą z tego stanu zostać przywrócone do aktywnego cyklu w odpowiedzi na uszkodzenie narządu lub sygnały hormonalne. Balans między komórkami aktywnie dzielącymi się a spoczynkowymi ma istotne znaczenie dla homeostazy tkanek.
Przejścia między fazami cyklu są ściśle kontrolowane. Komórka nie może swobodnie przejść z G1 do S czy z G2 do M, jeśli nie zostaną spełnione określone warunki. Zapewnia to działanie specjalnych punktów kontrolnych, które monitorują wielkość komórki, kompletność DNA oraz prawidłowe przyłączenie chromosomów do wrzeciona podziałowego. Zaburzenie działania tych mechanizmów może prowadzić do niekontrolowanych podziałów i powstawania komórek nowotworowych.
Molekularne mechanizmy regulacji cyklu komórkowego
Na poziomie molekularnym cyklem komórkowym zarządza sieć białek tworzących swoisty system zegarowy. Najważniejszą rolę odgrywają kinazy zależne od cyklin (CDK) oraz ich regulatorowe białka – cykliny. Stężenie cyklin zmienia się w rytmie cyklu, podczas gdy ilość CDK pozostaje względnie stała. Powstające kompleksy cyklina–CDK fosforylują liczne białka docelowe, inicjując w ten sposób kolejne wydarzenia w cyklu, takie jak replikacja DNA czy wejście w mitozę.
W fazie G1 komórka syntetyzuje cykliny G1, które aktywują odpowiednie CDK i prowadzą do przygotowania chromosomów do replikacji. Kiedy warunki środowiskowe są sprzyjające – wystarczająca ilość składników odżywczych, brak poważnych uszkodzeń DNA, obecność czynników wzrostowych – komórka przekracza punkt określany często jako punkt restrykcyjny. Po jego minięciu komórka jest praktycznie zobowiązana do ukończenia cyklu i wejścia w podział, niezależnie od późniejszych zmian otoczenia.
W fazie S aktywacja kolejnego zestawu cyklin i CDK uruchamia proces replikacji DNA. Białka te koordynują otwieranie widełek replikacyjnych, rekrutują polimerazy DNA oraz dbają o to, aby każda sekwencja genomu była skopiowana tylko raz. Nadmiarowa replikacja mogłaby prowadzić do niestabilności genomu, natomiast pominięcie pewnych fragmentów – do utraty istotnych genów. Dlatego też replikacja jest ściśle zsynchronizowana z działaniem punktów kontrolnych monitorujących jakość skopiowanego materiału genetycznego.
W fazie G2 cykliny mitotyczne gromadzą się, osiągając maksimum stężenia tuż przed wejściem w mitozę. Współpracujące z nimi CDK fosforylują białka odpowiedzialne za kondensację chromosomów, rozpad otoczki jądrowej oraz formowanie wrzeciona mitotycznego. Jeśli w DNA wykryte zostaną uszkodzenia, specjalne białka czujnikowe aktywują szlaki naprawcze, jednocześnie hamując aktywność kompleksów cyklina–CDK. Takie zahamowanie zapewnia czas potrzebny na naprawę, a w razie niemożności jej przeprowadzenia może doprowadzić do programowanej śmierci komórki, czyli apoptozy.
Integralną częścią systemu nadzoru są punkty kontrolne G1/S, G2/M oraz punkt kontrolny wrzeciona w metafazie mitozy. Punkt G1/S ocenia głównie stan środowiska zewnętrznego i integralność genomu. Punkt G2/M sprawdza, czy replikacja DNA została zakończona poprawnie i czy nie wystąpiły istotne uszkodzenia. Z kolei punkt metafazowy monitoruje prawidłowe przyłączenie wszystkich chromosomów do mikrotubul wrzeciona. Dopiero sygnał o pełnej gotowości umożliwia przejście do anafazy i równomierny podział chromosomów do komórek potomnych.
Istotną rolę odgrywają także inhibitory CDK, czyli białka hamujące aktywność kompleksów cyklina–CDK. Reagują one na sygnały stresowe, uszkodzenia DNA czy brak odpowiednich czynników wzrostowych. Wiele z nich działa jako supresory nowotworowe, a ich utrata lub mutacja może prowadzić do niekontrolowanej aktywności CDK i przyspieszenia cyklu komórkowego. Tego typu zaburzenia leżą u podłoża rozwoju wielu nowotworów, gdzie komórki tracą zdolność reagowania na sygnały hamujące wzrost.
Mitoza, cytokineza i różnicowanie komórek
Najbardziej widowiskowym etapem cyklu komórkowego jest mitoza – proces równomiernego rozdzielenia skopiowanego materiału genetycznego do dwóch komórek potomnych. W klasycznym podziale wyróżnia się fazy: profazę, prometafazę, metafazę, anafazę i telofazę. W profazie chromosomy ulegają kondensacji, stając się widocznymi strukturami, a centrosomy zaczynają formować bieguny wrzeciona mitotycznego. W prometafazie otoczka jądrowa ulega rozpadowi, co umożliwia mikrotubulom wrzeciona przyłączenie się do kinetochorów znajdujących się na chromosomach.
W metafazie wszystkie chromosomy ustawiają się w płaszczyźnie równikowej komórki, tworząc charakterystyczną płytkę metafazową. Ten etap ma kluczowe znaczenie dla punktu kontrolnego wrzeciona: dopiero gdy każde chromatydy siostrzane są prawidłowo przyłączone do mikrotubul z przeciwnych biegunów, komórka otrzymuje sygnał do przejścia w anafazę. W anafazie dochodzi do rozdzielenia chromatyd i ich przemieszczania się w kierunku biegunów komórki. Ten precyzyjny ruch jest napędzany przez skracające się mikrotubule i działanie białek motorycznych.
Telofaza rozpoczyna się, gdy oddzielone zestawy chromosomów docierają do biegunów. Chromosomy ulegają dekondensacji, a wokół nich odtwarzane są nowe otoczki jądrowe. W ten sposób powstają dwa odrębne jądra komórkowe, każde z pełnym zestawem materiału genetycznego. Nie oznacza to jednak końca procesu podziału, ponieważ konieczne jest jeszcze fizyczne oddzielenie cytoplazmy – etap ten nosi nazwę cytokinezy. W komórkach zwierzęcych odbywa się ona dzięki pierścieniowi kurczliwemu zbudowanemu z aktyny i miozyny, który przewęża komórkę w okolicy równika, aż do powstania dwóch komórek potomnych.
Cytokineza w komórkach roślinnych przebiega inaczej ze względu na obecność sztywnej ściany komórkowej. Zamiast przewężenia cytoplazmy formowana jest tzw. przegroda komórkowa. Pęcherzyki aparatu Golgiego transportujące składniki ściany komórkowej gromadzą się w centralnej części komórki, gdzie z czasem zlewają się, tworząc płytkę komórkową. Płytka ta rozrasta się na boki, aż do połączenia z istniejącą ścianą komórkową, prowadząc do podziału protoplastu na dwie oddzielne komórki potomne, z których każda buduje własną, kompletną ścianę.
Cykl komórkowy jest ściśle powiązany z procesem różnicowania komórek. Po serii podziałów niektóre komórki zaczynają zmieniać swój profil ekspresji genów, przyjmując wyspecjalizowane funkcje, takie jak przewodzenie impulsów nerwowych, skurcz mięśniowy czy produkcja hormonów. Wyjście z aktywnego cyklu i wejście w fazę G0 często towarzyszy temu procesowi. Komórka rezygnuje z dzielenia się na rzecz pełnienia określonej funkcji w tkance. Zaburzenia w równowadze między proliferacją a różnicowaniem mogą prowadzić do patologii, w tym do nowotworów, w których komórki pozostają w stanie ciągłego podziału przy ograniczonej zdolności do dojrzewania.
W rozwoju zarodkowym tempo cyklu i stopień zróżnicowania są ze sobą ściśle sprzężone. Na wczesnych etapach zarodka komórki dzielą się niezwykle szybko, często skracając lub niemal całkowicie pomijając fazy wzrostowe G1 i G2. Wraz z postępem rozwoju cykl staje się coraz dłuższy, a poszczególne komórki zaczynają specjalizować się, tworząc różne tkanki i narządy. Ten płynny balans pomiędzy podziałem a specjalizacją jest jednym z fundamentów prawidłowego kształtowania się organizmu wielokomórkowego.
Znaczenie cyklu komórkowego dla zdrowia, chorób i biotechnologii
Prawidłowo funkcjonujący cykl komórkowy jest warunkiem utrzymania stabilności genomu i integralności tkanek. Komórki nabłonka jelitowego, skóry czy szpiku kostnego dzielą się regularnie, aby zastępować komórki obumarłe lub uszkodzone. W tych tkankach cykl komórkowy jest szczególnie aktywny, a mechanizmy kontrolne muszą sprawnie eliminować komórki z uszkodzonym DNA. Jeżeli system naprawy lub punktów kontrolnych zawiedzie, komórki mogą gromadzić mutacje, co w dłuższej perspektywie sprzyja powstawaniu zmian nowotworowych.
Nowotwory są w dużej mierze chorobami cyklu komórkowego. Komórki rakowe często wykazują trwałą aktywację szlaków wzrostowych oraz upośledzone działanie białek hamujących cykl, takich jak niektóre supresory nowotworowe. W wyniku mutacji dochodzi do utraty kontroli nad podziałami, co prowadzi do powstawania guzów i przerzutów. Badania nad molekularną regulacją cyklu komórkowego pozwoliły na opracowanie leków celowanych, które blokują konkretne kinazy CDK lub inne kluczowe elementy tego procesu, hamując w ten sposób proliferację komórek nowotworowych.
Ważnym zagadnieniem jest również związek między cyklem komórkowym a procesami starzenia. Komórki somatyczne nie mogą dzielić się w nieskończoność. Po określonej liczbie podziałów wchodzą w stan tzw. starzenia replikacyjnego, podczas którego pozostają żywe i metabolicznie aktywne, lecz tracą zdolność do dalszej proliferacji. Zjawisko to wiąże się m.in. ze skracaniem telomerów – końcowych fragmentów chromosomów – oraz akumulacją uszkodzeń DNA. Starzenie komórkowe ma znaczenie ochronne, zapobiegając niekontrolowanym podziałom, ale jednocześnie przyczynia się do osłabienia zdolności regeneracyjnych tkanek.
Cykl komórkowy jest kluczowy również w kontekście komórek macierzystych. Te wyspecjalizowane komórki mogą pozostawać przez długi czas w fazie G0, a w odpowiedzi na sygnały uszkodzenia lub potrzeby organizmu powracają do aktywnego cyklu, dając początek nowym komórkom wyspecjalizowanym. Zrozumienie regulacji cyklu w komórkach macierzystych jest fundamentalne dla rozwoju medycyny regeneracyjnej, inżynierii tkankowej oraz terapii polegających na przeszczepianiu komórek w celu odbudowy uszkodzonych narządów.
Z kolei w biotechnologii kontrola nad cyklem komórkowym ma znaczenie przy hodowlach komórek w warunkach laboratoryjnych. W produkcji rekombinowanych białek, szczepionek czy przeciwciał monoklonalnych dąży się do optymalizacji tempa wzrostu i podziałów komórek. Niewłaściwe warunki mogą prowadzić do zatrzymania cyklu, śmierci komórek lub akumulacji mutacji niekorzystnych dla jakości produktu. Znajomość wymogów żywieniowych, czynników wzrostowych oraz warunków fizykochemicznych pozwala sterować proliferacją komórek w taki sposób, aby uzyskać wysoką wydajność i stabilność hodowli.
W diagnostyce medycznej analiza cyklu komórkowego znalazła zastosowanie m.in. w cytometrii przepływowej. Technika ta pozwala na oznaczenie ilości DNA w poszczególnych komórkach, co umożliwia określenie, jaki odsetek populacji znajduje się w fazie G0/G1, S czy G2/M. Tego typu analiza jest użyteczna przy ocenie dynamiki wzrostu guzów, reakcji na chemioterapię oraz przy różnicowaniu niektórych chorób hematologicznych. Parametry cyklu komórkowego mogą stanowić wskaźnik agresywności nowotworu i rokowania dla pacjenta.
Istotnym polem badań jest również interakcja między cyklem komórkowym a odpowiedzią immunologiczną. Limfocyty T i B, kluczowe dla odpowiedzi swoistej, muszą szybko wejść w intensywny cykl podziałów po rozpoznaniu antygenu. Tempo i skala tej odpowiedzi zależą od zdolności układu odpornościowego do regulacji cyklu w tych komórkach. Z kolei niektóre patogeny wirusowe potrafią manipulować cyklem komórkowym gospodarza, zatrzymując komórkę w określonej fazie lub pobudzając jej proliferację, aby zapewnić sobie optymalne warunki replikacji.
FAQ – najczęściej zadawane pytania o cykl komórkowy
Co to jest cykl komórkowy i jakie ma etapy?
Cykl komórkowy to uporządkowana sekwencja zdarzeń prowadzących od powstania komórki do jej podziału na dwie komórki potomne. Obejmuje interfazę (G1 – wzrost i przygotowanie, S – replikacja DNA, G2 – kontrola poprawności i dalszy wzrost) oraz fazę M (mitozę i cytokinezę). Dzięki temu procesowi organizmy rosną, odnawiają tkanki i utrzymują stabilność materiału genetycznego w kolejnych pokoleniach komórek.
Czym różni się mitaza od mejozy w kontekście cyklu komórkowego?
Mitoza jest częścią cyklu komórkowego komórek somatycznych i prowadzi do powstania dwóch komórek potomnych o identycznym materiale genetycznym. Mejoza to specjalny rodzaj podziału zachodzący w komórkach rozrodczych, redukujący liczbę chromosomów o połowę i zwiększający różnorodność genetyczną. Mejoza obejmuje dwa kolejne podziały jądra, nie jest typowym etapem standardowego cyklu komórkowego komórek ciała.
Dlaczego punkty kontrolne cyklu komórkowego są tak ważne?
Punkty kontrolne działają jak system jakości, który sprawdza, czy komórka jest gotowa do przejścia do kolejnej fazy cyklu. Monitorują wielkość komórki, kompletność i nienaruszalność DNA oraz prawidłowe przyłączenie chromosomów do wrzeciona mitotycznego. Jeśli wykryją uszkodzenia lub nieprawidłowości, zatrzymują cykl i uruchamiają mechanizmy naprawcze lub apoptozę. Dzięki temu zmniejsza się ryzyko powstawania komórek z mutacjami, a tym samym rozwój nowotworów.
Co to jest faza G0 i czy komórka może do niej wrócić?
Faza G0 to stan funkcjonalnego spoczynku, w którym komórka nie dzieli się, ale zachowuje aktywność metaboliczną. Wiele wyspecjalizowanych komórek, jak neurony, przebywa w G0 przez całe życie organizmu. Niektóre komórki, np. wątroby czy układu odpornościowego, mogą zostać z G0 ponownie wprowadzone w cykl pod wpływem sygnałów wzrostowych lub uszkodzeń tkanek. Przejście do G0 i z powrotem jest kluczowe dla kontroli proliferacji i zdolności regeneracyjnych.
Jak cykl komórkowy wiąże się z powstawaniem nowotworów?
Nowotwory często wynikają z zaburzeń regulacji cyklu komórkowego. Mutacje w genach kodujących cykliny, kinazy CDK, inhibitory CDK lub białka naprawcze DNA mogą prowadzić do utraty kontroli nad podziałami. Komórki zaczynają dzielić się zbyt szybko, ignorując sygnały hamujące i punkty kontrolne. Gromadzą kolejne mutacje, zyskują zdolność unikania apoptozy oraz wzrostu w niekorzystnych warunkach. Zrozumienie tych mechanizmów pozwala opracowywać leki precyzyjnie blokujące nadaktywny cykl w komórkach rakowych.