Teoria kwasów i zasad Lewisa należy do najbardziej uniwersalnych koncepcji w chemii, ponieważ pozwala w spójny sposób opisać ogromną liczbę zjawisk – od reakcji w roztworach wodnych, przez procesy w katalizatorach metalicznych, aż po mechanizmy biochemiczne. Koncepcja ta porządkuje pojęcia wiązania chemicznego, przeniesienia par elektronowych i reaktywności, łącząc klasyczną chemię nieorganiczną z fizykochemią, chemią organiczną oraz chemią materiałową.
Geneza i podstawy teorii kwasów i zasad Lewisa
Najwcześniejsze ujęcia kwasowo-zasadowe, takie jak teoria Arrheniusa czy Brønsteda-Lowry’ego, koncentrowały się głównie na reakcjach zachodzących w roztworach wodnych. Kwas był definiowany jako substancja zwiększająca stężenie jonów H⁺ (Arrhenius) lub donor protonu (Brønsted), a zasada jako substancja zwiększająca stężenie OH⁻ bądź akceptor protonu. Koncepcje te, choć niezwykle użyteczne, okazały się niewystarczające do opisu zjawisk w fazie gazowej, w rozpuszczalnikach innych niż woda czy w układach bezsolwentowych.
W odpowiedzi na te ograniczenia Gilbert Newton Lewis zaproponował na początku XX wieku nowe, bardziej ogólne podejście. Wyjściowym punktem była jego wizja wiązania kowalencyjnego jako pary elektronowej współdzielonej pomiędzy dwoma atomami. Skoro wiele reakcji chemicznych polega na powstawaniu nowych wiązań poprzez przesunięcia lub wspólne użycie par elektronowych, naturalne stało się powiązanie pojęć kwasu i zasady z przepływem elektronów, a nie tylko protonów.
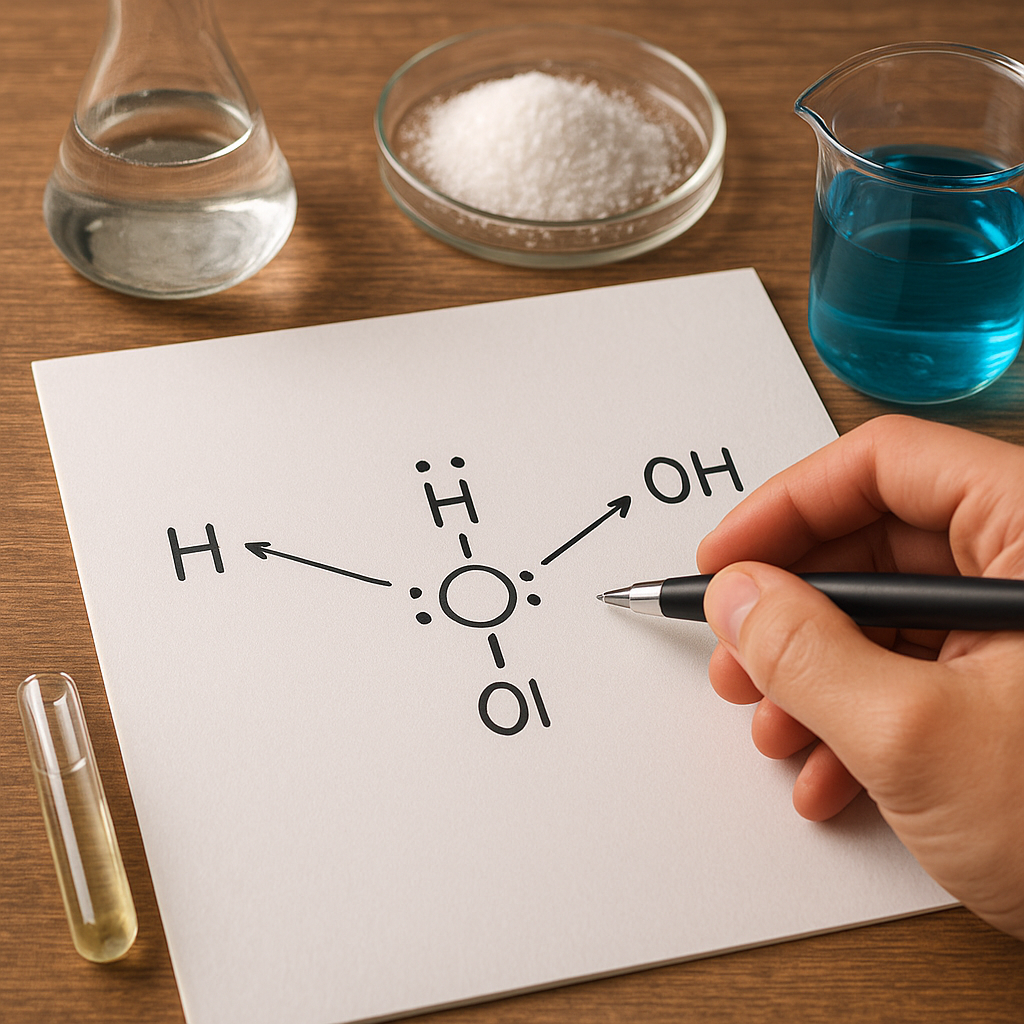
Podstawą teorii Lewisa jest zatem przeformułowanie tych kluczowych definicji:
- Kwas Lewisa – to akceptor pary elektronowej, czyli gatunek chemiczny zdolny do przyjęcia niewiążącej lub wiążącej pary elektronów od innego partnera reakcji.
- Zasada Lewisa – to donor pary elektronowej, czyli cząsteczka, jon lub atom posiadający wolną parę elektronową, którą może przekazać kwasowi Lewisa w celu utworzenia nowego wiązania.
Reakcja kwas-zasada Lewisa polega więc na tworzeniu wiązania koordynacyjnego (donorowo-akceptorowego). Nie jest konieczne, aby w takiej reakcji brał udział proton, a nawet aby cały proces zachodził w roztworze. Właśnie ta ogólność stanowi o sile koncepcji Lewisa.
Definicje, klasyfikacje i przykłady kwasów oraz zasad Lewisa
Charakterystyka kwasów Lewisa
Kwas Lewisa to każdy obiekt chemiczny, który może przyjąć parę elektronową do pustego orbitalu. Może to być zarówno pojedynczy jon, jak i rozbudowany związek koordynacyjny. W praktyce wyróżnia się kilka typowych grup kwasów Lewisa:
- Kationy metali przejściowych – np. Fe³⁺, Cu²⁺, Zn²⁺. Dysponują one wolnymi orbitalami d, które mogą przyjąć elektrony od ligandów. Ich kwasowość Lewisa zależy od ładunku, promienia jonowego oraz konfiguracji elektronowej.
- Kationy metali bloku s – na przykład Mg²⁺, Ca²⁺, Al³⁺. Al³⁺ jest klasycznym, silnym kwasem Lewisa, szeroko stosowanym w chemii nieorganicznej i materiałowej.
- Związki z luką elektronową – np. BF₃, BCl₃, AlCl₃. Atom boru lub glinu jest otoczony tylko sześcioma elektronami walencyjnymi, przez co silnie dąży do uzupełnienia swojej powłoki do oktetu, akceptując parę elektronową.
- Cząsteczki z wiązaniami wielokrotnymi – CO₂, SO₃, związki karbonylowe metaliczne. Niekiedy fragmenty tych cząsteczek mogą działać jako ośrodki akceptorowe względem elektronodawcy.
- Reagenty elektrofilowe w chemii organicznej – np. karbokationy (R₃C⁺), halogenki acylowe (RCOCl), w których centralny atom węgla ma charakter silnie elektrofilowy i pełni funkcję kwasu Lewisa.
Na kwasowość Lewisa wpływają przede wszystkim: ładunek dodatni, polaryzowalność oraz dostępność pustych orbitali o odpowiedniej symetrii. Im większy ładunek i mniejszy promień jonu, tym silniejsze ciągnięcie elektronów, a więc silniejszy charakter kwasu Lewisa.
Zasady Lewisa i ich cechy
Zasada Lewisa to gatunek z co najmniej jedną wolną parą elektronową lub z elektronami π, które mogą być przekazane kwasowi. Do klasycznych zasad Lewisa należą:
- Amoniak i aminy – NH₃, RNH₂, R₂NH, R₃N. Atom azotu ma wolną parę elektronową, która jest stosunkowo łatwo dostępną i może tworzyć wiązania koordynacyjne z wieloma kationami metali.
- Tlenowe zasady Lewisa – woda (H₂O), alkohole (ROH), etery (ROR’), ketony (R₂C=O). Atom tlenu, dzięki wolnym parom elektronowym, może działać jako donor, choć siła zasadowości zależy od otoczenia elektronowego i rozpuszczalnika.
- Aniony halogenkowe – Cl⁻, Br⁻, I⁻. Duże, polaryzowalne jony z licznymi elektronami walencyjnymi, chętnie przyłączają się do centrów elektrofilowych.
- Ligandy fosforowe – fosfiny PR₃, fosfiny tlenowe O=PR₃. Dzięki wolnej parze elektronowej na fosforze często tworzą kompleksy z metalami przejściowymi, pełniąc rolę zasad Lewisa w katalizie homogenicznej.
- Ligandy π-donorowe – np. alkeny, alkiny, areny wobec niektórych centrów metalicznych mogą przekazywać gęstość elektronową z wiązań π.
Siła zasady Lewisa zależy m.in. od energii i lokalizacji wolnej pary elektronowej, stopnia stabilizacji przez otoczenie, a także od polaryzowalności. Dobrą zasadą Lewisa jest taki donor, którego para elektronowa znajduje się na stosunkowo wysoko energetycznym orbitalu i nie jest silnie uwspólniona z innymi atomami.
Przykładowe reakcje kwas–zasada Lewisa
Dla lepszego zrozumienia praktycznego znaczenia koncepcji Lewisa warto rozważyć kilka reprezentatywnych reakcji, w których niekoniecznie biorą udział protony:
- Tworzenie kompleksu BF₃·NH₃
BF₃ jest klasycznym kwasem Lewisa – atom boru ma niepełny oktet. Amoniak jest zasadą Lewisa, ponieważ posiada wolną parę elektronową na atomie azotu. W reakcji powstaje addukt BF₃·NH₃, w którym para elektronowa azotu jest przekazana borowi, tworząc wiązanie koordynacyjne. - Kompleksy metali przejściowych z amoniakiem
W reakcji [Cu(H₂O)₆]²⁺ + 4 NH₃ → [Cu(NH₃)₄(H₂O)₂]²⁺ + 4 H₂O kation Cu²⁺ pełni funkcję kwasu Lewisa, a cząsteczki amoniaku – zasad Lewisa. W wyniku reakcji powstaje trwały kompleks, w którym wolne pary elektronowe azotu są skoordynowane do miedzi. - Reakcje elektrofilowe w chemii organicznej
Gdy karbokation reaguje z alkenem, centrum dodatnio naładowane (kwas Lewisa) akceptuje parę elektronową z wiązania π (zasada Lewisa). Powstaje nowe wiązanie σ, a cały proces można opisać w języku przesunięcia par elektronowych zgodnie z teorią Lewisa.
W tych i niezliczonych innych przykładach kluczową rolę odgrywa przepływ elektronów, a nie transfer protonów. Definicja Lewisa pozwala więc objąć jedną ramą teoretyczną bardzo szerokie spektrum reakcji, od koordynacji ligandów do centrów metalicznych aż po zaawansowane procesy katalityczne.
Rola teorii Lewisa w strukturze wiązań i reaktywności chemicznej
Wiązania koordynacyjne i geometrii kompleksów
Teoria kwasów i zasad Lewisa jest ściśle powiązana z pojęciem wiązania koordynacyjnego. Tego typu wiązanie powstaje, gdy obie elektrony w nowo tworzonej parze pochodzą od jednego z partnerów – zasady Lewisa. Kwas dostarcza pusty orbital, a zasada parę elektronową, którą można ulokować w tym orbitalu.
W związkach koordynacyjnych, takich jak [Fe(CN)₆]³⁻ czy [Co(NH₃)₆]³⁺, atom metalu przejściowego stanowi centrum kwasowe (akceptor elektronów), a ligandy – cyjanki, amoniaki, woda, fosfiny – pełnią rolę zasad Lewisa. Liczba i rodzaj ligandów decydują o geometrii kompleksu: otaczający metal sześcioma donorami najczęściej tworzy konfigurację oktaedryczną, czterema – tetraedryczną lub kwadratowo-planarną, a dwoma – liniową.
Opisując takie układy w kategoriach kwasów i zasad Lewisa, zyskujemy narzędzie do:
- przewidywania liczby wiązań koordynacyjnych,
- analizy stabilności kompleksów,
- zrozumienia różnic w barwie i właściwościach magnetycznych (różne ligandy w roli zasad Lewisa wpływają na rozszczepienie poziomów energetycznych d-orbitali metalu),
- projektowania katalizatorów, w których finezyjnie dobrane ligandy modulują reaktywność centrum kwasowego.
HSAB – teoria twardych i miękkich kwasów i zasad
Rozwinięciem koncepcji Lewisa jest teoria HSAB (Hard and Soft Acids and Bases) zaproponowana przez Pearsona. Łączy ona rozumienie kwasowości Lewisa z pojęciem polaryzowalności i rozmiaru jonów. W tym ujęciu gatunki chemiczne dzieli się na twarde (hard) i miękkie (soft):
- Twarde kwasy i zasady – małe, słabo polaryzowalne, często wysoko naładowane. Twarde kwasy to na przykład H⁺, Li⁺, Mg²⁺, Al³⁺; twarde zasady to F⁻, OH⁻, NH₃, H₂O.
- Miękkie kwasy i zasady – duże, silnie polaryzowalne, zwykle o niższym ładunku dodatnim lub ujemnym. Przykładowo, miękkimi kwasami są Ag⁺, Hg²⁺, Pt²⁺, a miękkimi zasadami – I⁻, S²⁻, tioetery, fosfiny z dużymi grupami alkilowymi.
Teoria HSAB głosi, że twarde kwasy preferują wiązanie z twardymi zasadami, a miękkie z miękkimi. Wynika to z dopasowania rozmiarów, ładunku i polaryzowalności, co przekłada się na efektywną stabilizację wiązania. Na przykład związek CaF₂ (twardy kwas Ca²⁺ z twardą zasadą F⁻) jest nie tylko bardzo trwały, ale i ma niską rozpuszczalność w wodzie, natomiast miękkie jony metali przejściowych wolą tworzyć trwałe kompleksy z miękkimi ligandami siarkowymi czy fosforowymi.
HSAB jest niezwykle pomocne w:
- przewidywaniu kierunku reakcji wymiany ligandów,
- projektowaniu selektywnych reagentów wychwytujących określone jony (separacja metali ciężkich, ekstrakcje),
- interpretacji toksyczności metali względem biomolekuł (np. preferencyjne oddziaływania miękkich jonów metali z grupami tiolowymi w białkach),
- doborze układów katalitycznych, w których dopasowanie twardości/miękkości centrum metalicznego i substratu maksymalizuje wydajność katalizy.
Reaktywność w chemii organicznej z perspektywy Lewisa
W chemii organicznej pojęcia elektrofilu i nukleofilu są bezpośrednim odpowiednikiem kwasu i zasady Lewisa. Elektrofile to akceptory elektronów (kwasy Lewisa), a nukleofile to donory elektronów (zasady Lewisa). Zastosowanie tej koncepcji jest rozległe:
- Reakcje substytucji nukleofilowej – w mechanizmie SN1 karbokation pełni rolę kwasu Lewisa, który przyjmuje parę elektronową od nukleofila (zasady Lewisa), prowadząc do utworzenia nowego wiązania C–Nu. W SN2 substrat elektrofilowy przyjmuje parę od nukleofila w jednym, skoordynowanym etapie.
- Reakcje addycji do wiązań π – alkeny i alkiny, posiadające wiązania π, mogą działać zarówno jako zasady Lewisa wobec silnych elektrofilów (np. H⁺, Br₂), jak i jako ligandy wobec centrów metalicznych.
- Kataliza kwasowo-zasadowa Lewisa – związki typu AlCl₃, BF₃, TiCl₄ są szeroko wykorzystywane do aktywacji grup karbonylowych lub wiązań podwójnych. Kwas Lewisa koordynuje się do atomu tlenu karbonylu, zwiększając elektrofilowy charakter atomu węgla i ułatwiając jego atak przez nukleofil.
W tej perspektywie większość typowych reakcji organicznych można przeanalizować jako zderzenie zasady Lewisa z kwasem Lewisa, często wspomagane odpowiednim rozpuszczalnikiem, temperaturą i dodatkami. Umożliwia to projektowanie nowych strategii syntezy, w których świadomie dobiera się kwasy i zasady Lewisa o pożądanej sile i selektywności.
Kataliza i projektowanie układów reakcyjnych
W katalizie homogenicznej, gdzie katalizator jest rozpuszczony w tej samej fazie co substraty, teoria Lewisa jest kluczowa dla zrozumienia sposobu działania kompleksów metalicznych. Metal jako kwas Lewisa tworzy z ligandami liczne połączenia, których charakter – elektrono- i steryczny – decyduje o wszystkich etapach cyklu katalitycznego: aktywacji substratu, tworzeniu związków pośrednich, przegrupowaniach i odłączeniu produktu.
Dobór ligandów będących zasadami Lewisa pozwala:
- regulować gęstość elektronową na metalu (bardziej elektrono-donorowe ligandy czynią metal miększym kwasem Lewisa),
- kształtować przestrzenną dostępność centrum aktywnego (ligandy objętościowe blokują niepożądane kierunki koordynacji),
- nadawać katalizatorowi właściwości chiralne, co prowadzi do stereoselektywności w reakcjach asymetrycznych.
W katalizie heterogenicznej, na powierzchni ciał stałych, można z kolei wyróżnić miejsca o charakterze kwasów i zasad Lewisa. Tlenki metali, zeolitowe szkielety krzemiano-glinowe, tlenki glinu – wszystkie te materiały posiadają centra akceptorowe (puste orbitale na kationach metali) oraz donorowe (wolne pary elektronowe na atomach tlenu). Właściwe dopasowanie substratu do tych centrów decyduje o efektywności przemysłowych procesów, takich jak izomeryzacja, alkilacja czy kraking katalityczny.
Znaczenie i zastosowania teorii Lewisa w różnych działach chemii
Chemia nieorganiczna i projektowanie kompleksów
W chemii nieorganicznej teoria Lewisa stanowi fundament opisu związków koordynacyjnych. Pozwala ona nie tylko rozumieć istniejące układy, ale też projektować nowe związki o zadanych właściwościach. Dzięki niej chemicy mogą z wyprzedzeniem przewidywać:
- jaki ligand (zasada Lewisa) będzie najstabilniej związany z danym kationem metalu (kwasem Lewisa),
- jakie są warunki sprzyjające wymianie ligandów,
- które kompleksy będą odporne na hydrolizę, redukcję czy utlenienie,
- jak zmienia się potencjał redoks metalu w zależności od otaczających go zasad Lewisa.
Przykładowo, w kompleksach cyjankowych [Fe(CN)₆]³⁻ cyjanek jest silną zasadą Lewisa, stabilizującą wysokie stopnie utlenienia metalu, co pozwala na przenoszenie elektronu w reakcjach redoks. Z kolei słabsze zasady Lewisa prowadzą do kompleksów mniej stabilnych, które łatwo wymieniają ligandy.
Chemia materiałowa i półprzewodniki
W chemii materiałowej teoria Lewisa pomaga zrozumieć, w jaki sposób defekty sieci krystalicznej, domieszki i powierzchnie ciał stałych oddziałują z cząsteczkami otoczenia. Na przykład centra lukowe w kryształach (brakujący jon, wakans) mogą zachowywać się jak kwasy Lewisa, przyjmując elektrony z cząsteczek gazów, co wpływa na przewodnictwo elektryczne i właściwości optyczne materiału.
Na powierzchni tlenków metali obecne są zarówno centra kwasowe, jak i zasadowe. Adsorpcja cząsteczek takich jak H₂O, CO, NH₃ czy NOₓ może być interpretowana jako proces kwasowo-zasadowy Lewisa, w którym powierzchnia przyjmuje lub przekazuje elektrony. To z kolei jest kluczowe dla projektowania czujników gazów, katalizatorów spalin oraz funkcjonalnych powłok ochronnych.
Ciekawym polem zastosowań jest także chemia półprzewodników i organicznej elektroniki. Cząsteczki donorowe (zasady Lewisa) i akceptorowe (kwasy Lewisa) tworzą pary D–A, w których transfer ładunku prowadzi do powstania nowych poziomów energetycznych, determinujących przewodnictwo, absorpcję światła i efektywność urządzeń fotowoltaicznych.
Biochemia i oddziaływania w układach biologicznych
W układach biologicznych liczne procesy można zinterpretować w kategoriach teorii Lewisa. Enzymy wykorzystują często atomy metali (Mg²⁺, Zn²⁺, Fe²⁺/Fe³⁺, Cu²⁺) jako centra kwasowe, które koordynują substraty zawierające wolne pary elektronowe – grupy karboksylowe, karbonylowe, aminowe czy fosforanowe. Dzięki tej koordynacji stabilizowane są stany przejściowe, a bariery energetyczne reakcji ulegają znacznemu obniżeniu.
Przykładowo, w anhydrazie węglanowej jon Zn²⁺ w centrum aktywnym pełni funkcję kwasu Lewisa, koordynując cząsteczkę wody (zasada Lewisa). Koordynacja ta ułatwia deprotonację wody, prowadząc do powstania jonu OH⁻, który następnie atakuje CO₂, tworząc wodorowęglan. Cały proces to świetny przykład połączonej roli kwasu i zasady Lewisa w katalizie enzymatycznej.
Również oddziaływania lek–receptor, wiązanie jonów metali przez białka transportowe, a nawet struktura kwasów nukleinowych mogą być analizowane z użyciem języka kwasowo-zasadowego Lewisa. Wolne pary elektronowe na atomach azotu i tlenu w zasadach azotowych oraz w szkielecie fosforanowym biorą udział w licznych oddziaływaniach koordynacyjnych i wodorowych, determinując właściwości strukturalne i reaktywność biomolekuł.
Środowisko, technologia i procesy przemysłowe
W ochronie środowiska pojęcie kwasów i zasad Lewisa pomaga projektować układy do wychwytywania i unieruchamiania toksycznych zanieczyszczeń. Jony metali ciężkich, takie jak Pb²⁺, Cd²⁺, Hg²⁺, są zwykle miękkimi kwasami Lewisa, więc efektywne sorbenty zawierają miękkie zasady – grupy siarczkowe, tioetery, tiolowe. Odpowiednie dopasowanie charakteru kwasowego i zasadowego zwiększa skuteczność usuwania zanieczyszczeń z wody i gleby.
W przemyśle chemicznym większość procesów katalitycznych – od polimeryzacji olefin aż po syntezy fine chemicals – wykorzystuje zjawiska kwasowo-zasadowe Lewisa. Projektowanie nowych katalizatorów opiera się na świadomym sterowaniu liczbą i mocą centrów kwasowych oraz zasadowych na powierzchni materiału lub w kompleksach rozpuszczalnych. Zrozumienie, które etapy mechanizmu wymagają silnych, a które słabszych kwasów czy zasad Lewisa, pozwala zwiększać wydajność, selektywność oraz bezpieczeństwo technologiczne.
FAQ
Czym teoria kwasów i zasad Lewisa różni się od teorii Brønsteda-Lowry’ego?
Teoria Brønsteda-Lowry’ego definiuje kwas jako donor protonu, a zasadę jako akceptor protonu. Ma więc sens przede wszystkim tam, gdzie występują protony i rozpuszczalniki zdolne do ich przenoszenia, głównie w roztworach wodnych. Teoria Lewisa uniezależnia te pojęcia od protonów: kwasem jest akceptor pary elektronowej, a zasadą jej donor. Dzięki temu obejmuje także reakcje w fazie gazowej, w rozpuszczalnikach nieprotycznych, procesy koordynacyjne i wiele zjawisk w chemii materiałowej.
Jak rozpoznać, czy dana substancja jest kwasem czy zasadą Lewisa?
Aby ocenić charakter Lewisa, analizuje się strukturę elektronową. Gatunek z pustym orbitalem, niepełnym oktetem lub dodatnim ładunkiem, który może przyjąć parę elektronową, jest kwasem Lewisa (np. BF₃, Al³⁺, karbokationy). Z kolei substancja z wolną parą elektronową lub bogata w elektrony π, zdolna przekazać je innemu centrom, jest zasadą Lewisa (np. NH₃, H₂O, Cl⁻, fosfiny). Często ten sam związek może być w różnych warunkach zarówno kwasem, jak i zasadą.
Co oznacza w praktyce pojęcie twardych i miękkich kwasów i zasad (HSAB)?
Teoria HSAB wyróżnia twarde i miękkie kwasy oraz zasady na podstawie rozmiaru, ładunku i polaryzowalności. Twarde kwasy i zasady są małe, słabo polaryzowalne, z silnie zlokalizowanym ładunkiem (np. H⁺, Mg²⁺, F⁻, OH⁻). Miękkie są większe, łatwo polaryzowalne, często z rozmytym ładunkiem (np. Ag⁺, Hg²⁺, I⁻, tioetery). Zgodnie z zasadą dopasowania twarde preferencyjnie łączą się z twardymi, a miękkie z miękkimi, co pozwala przewidywać stabilność kompleksów i kierunki reakcji.
Dlaczego teoria Lewisa jest tak ważna w katalizie chemicznej?
W katalizie wiele kluczowych etapów reakcji polega na tworzeniu i zrywaniu wiązań koordynacyjnych, czyli dokładnie na przekazywaniu par elektronowych między kwasami i zasadami Lewisa. Centrum metaliczne katalizatora działa zwykle jako kwas, a ligandy oraz substraty – jako zasady. Kontrolując siłę i rodzaj tych oddziaływań, można modulować szybkość, selektywność i kierunek reakcji. Teoria Lewisa dostarcza zwięzłego języka i narzędzi do racjonalnego projektowania wydajnych, selektywnych katalizatorów.
Czy w układach biologicznych także występują reakcje kwas–zasada Lewisa?
Tak, w biologii pojęcie Lewisa ma duże znaczenie. Jony metali, jak Zn²⁺, Mg²⁺ czy Fe³⁺, pełnią w enzymach rolę kwasów Lewisa, koordynując wolne pary elektronowe atomów tlenu i azotu w substratach oraz resztach aminokwasowych. Taka koordynacja stabilizuje stany przejściowe i obniża energię aktywacji reakcji. Z kolei grupy funkcyjne aminokwasów, nukleotydów czy koenzymów często działają jako zasady Lewisa, przekazując pary elektronowe podczas tworzenia i rozrywania wiązań chemicznych w procesach metabolicznych.