Autofagia jest jednym z kluczowych procesów utrzymujących równowagę wewnętrzną komórki. To wyrafinowany mechanizm recyklingu, w którym komórka rozkłada własne, uszkodzone lub zbędne elementy, aby odzyskać z nich materiał budulcowy i energię. Zrozumienie autofagii łączy w sobie wiedzę z zakresu biologii komórki, biochemii, medycyny i nauk o starzeniu, a także otwiera drogę do nowych strategii terapeutycznych w chorobach cywilizacyjnych.
Podstawy biologiczne autofagii
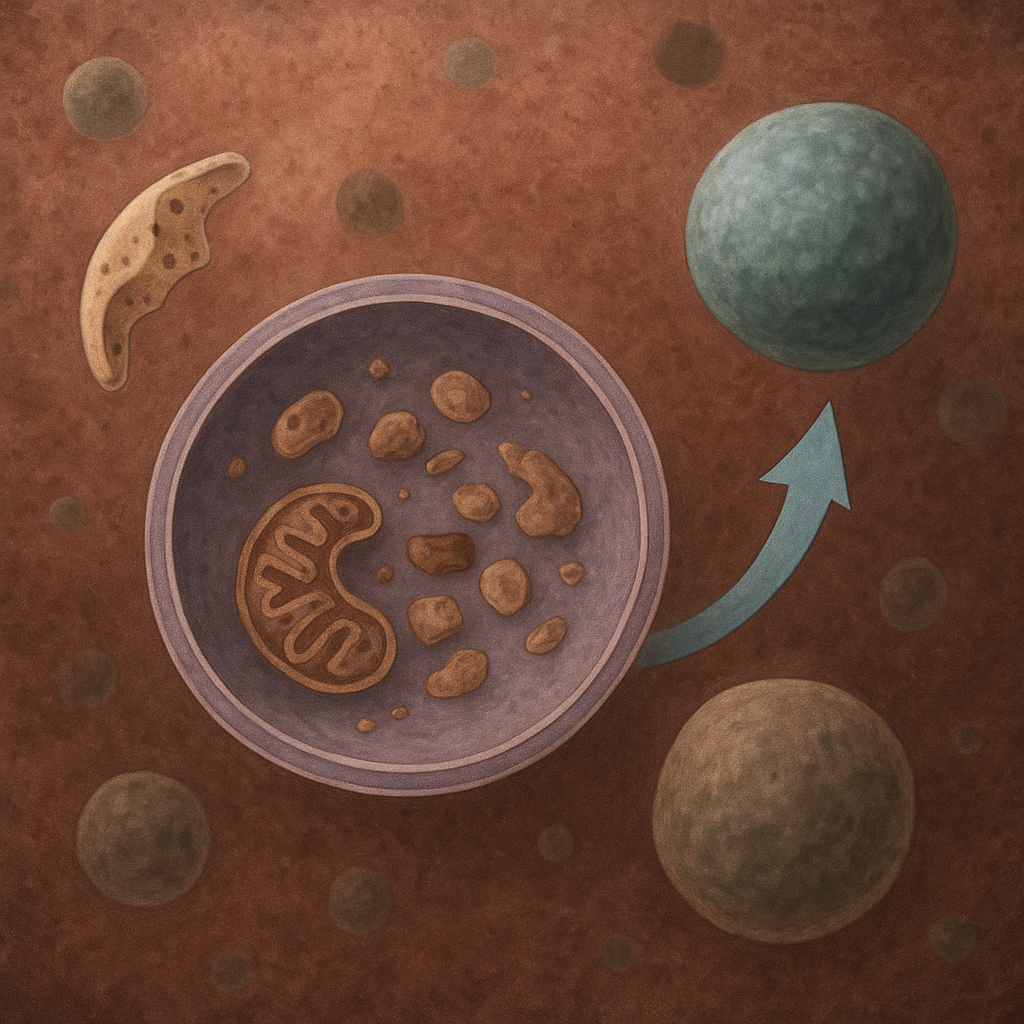
Termin autofagia pochodzi z greki i oznacza dosłownie „samozjadanie”. W ujęciu biologicznym jest to zorganizowany proces degradacji składników komórki w obrębie lizosomów, wyspecjalizowanych organelli trawiennych. Dzięki autofagii komórka potrafi rozpoznawać uszkodzone białka, fragmenty błon, nieprawidłowo funkcjonujące mitochondria oraz inne struktury, a następnie kierować je do kontrolowanego rozkładu. W przeciwieństwie do przypadkowej degradacji, autofagia jest procesem niezwykle precyzyjnym, regulowanym przez liczne białka i szlaki sygnałowe.
Można wyróżnić kilka głównych typów autofagii. Najlepiej poznaną formą jest makroautofagia, najczęściej określana skrótowo jako autofagia. Polega ona na tworzeniu dwu-błonowych pęcherzyków, zwanych autofagosomami, które otaczają degradowane struktury. Istnieje także mikroautofagia, w której materiał bezpośrednio wnika do lizosomu przez wpuklenia jego błony, oraz autofagia zależna od białek opiekuńczych, gdzie specyficzne białka są rozpoznawane i transportowane do lizosomu bez formowania pełnego autofagosomu.
Proces autofagii jest konserwowany ewolucyjnie – występuje u drożdży, roślin, zwierząt i ludzi. Ta zachowawczość wskazuje na fundamentalne znaczenie **autofagii** dla przetrwania komórek w zmiennych warunkach środowiska. Gdy zasoby są ograniczone, na przykład w czasie głodu, autofagia pozwala odzyskać z wewnętrznych zapasów aminokwasy, kwasy tłuszczowe oraz inne elementy, które następnie mogą zostać wykorzystane do syntezy nowych cząsteczek i produkcji energii.
Na poziomie molekularnym kluczową rolę w regulacji autofagii odgrywa szlak mTOR, będący głównym czujnikiem dostępności składników odżywczych i energii. Gdy do komórki dociera dużo glukozy, aminokwasów i czynników wzrostu, mTOR jest aktywny i hamuje autofagię. Natomiast przy deficycie składników odżywczych aktywność mTOR spada, co uruchamia mechanizmy prowadzące do inicjacji autofagosomów. Innym ważnym regulatorem jest kinaza AMPK, reagująca na stosunek AMP do ATP – sygnał energetycznego „głodu” komórki.
Geny związane z autofagią, określane jako ATG (od angielskiego autophagy-related genes), kodują liczne białka uczestniczące w poszczególnych etapach procesu. Białka ATG tworzą skomplikowane kompleksy odpowiedzialne za formowanie, wydłużanie i zamykanie błony autofagosomu, jego transport oraz fuzję z lizosomem. Mutacje w niektórych z tych genów mogą prowadzić do zaburzeń autofagii, a w konsekwencji do nagromadzenia toksycznych agregatów białkowych czy uszkodzonych organelli, co sprzyja rozwojowi chorób neurodegeneracyjnych, nowotworów czy kardiomiopatii.
Autofagia wpisuje się też w szerszy kontekst homeostazy białek, zwanej proteostazą. Obok systemu ubikwityna–proteasom stanowi drugi główny szlak degradacji białek. Proteasom odpowiada za szybki rozkład głównie krótkotrwałych, rozpuszczalnych białek, natomiast autofagia pozwala usuwać większe kompleksy, agregaty białkowe, a także całe organella. Współdziałanie tych systemów jest niezbędne, by komórka utrzymała równowagę między syntezą a degradacją białek, szczególnie w warunkach stresu oksydacyjnego lub toksycznego działania czynników środowiskowych.
Mechanizm działania autofagii krok po kroku
Przebieg makroautofagii można podzielić na kilka etapów: inicjacja, nukleacja, wydłużanie błony, zamknięcie autofagosomu, fuzja z lizosomem oraz degradacja zawartości. Choć w praktyce są to procesy dynamicznie nakładające się na siebie, ich usystematyzowanie ułatwia zrozumienie, jak komórka uruchamia i kontroluje ten złożony mechanizm recyklingu.
Inicjacja autofagii rozpoczyna się wtedy, gdy komórka otrzymuje sygnały o niedoborze składników lub o obecności uszkodzonych struktur. Spadek aktywności mTOR oraz wzrost aktywności AMPK prowadzą do aktywacji kompleksu ULK1, będącego jednym z głównych „włączników” autofagii. Kompleks ten przemieszcza się do określonych regionów błon komórkowych, które staną się miejscem powstawania fagoforu, czyli początkowej, półksiężycowatej struktury błonowej.
Nukleacja błony fagoforu jest kontrolowana przez kompleks zawierający kinazę PI3K klasy III, regulującą lokalne tworzenie fosfatydyloinozytolo-3-fosforanu. Ten lipid sygnałowy przyciąga kolejne białka ATG odpowiedzialne za rekrutację i organizację błon. Dokładne pochodzenie błony fagoforu wciąż jest przedmiotem intensywnych badań; uważa się, że może ona pochodzić z siateczki śródplazmatycznej, aparatu Golgiego, zewnętrznej błony mitochondriów, a także z pęcherzyków transportowych.
Wydłużanie błony to etap, w którym fagofor otacza struktury przeznaczone do degradacji. Ważną rolę odgrywają tu dwie kaskady przypominające system ubikwitynacji, ale wykorzystujące białka ATG8 (u ssaków m.in. LC3) oraz ATG12. LC3 jest koniugowane z fosfatydyloetanoloaminą i wbudowywane w błonę fagoforu, co umożliwia selektywne rozpoznanie ładunku. Białka adaptorowe, takie jak p62, NBR1 czy optineuryna, rozpoznają znaczniki na degradowanych strukturach, np. poliubikwitynę, i łączą je z LC3, co zapewnia selektywność procesu.
Gdy błona fagoforu w pełni otoczy ładunek, następuje zamknięcie struktury i powstaje dojrzały autofagosom. Jest to dwu-błonowy pęcherzyk, który musi następnie przemieścić się w kierunku lizosomów. Transport ten odbywa się dzięki mikrotubulom i białkom motorowym, takim jak dyneina i kinezyna. Po dotarciu do okolic lizosomu dochodzi do fuzji błon – proces ten wymaga udziału specyficznych białek SNARE oraz małych GTPaz, koordynujących prawidłowe rozpoznanie i połączenie pęcherzyków.
Po połączeniu autofagosomu z lizosomem powstaje autolizosom. W jego wnętrzu znajdują się hydrolazy lizosomalne: proteazy, lipazy, nukleazy i inne enzymy trawienne, działające optymalnie w kwaśnym pH. Enzymy te rozkładają zawartość autolizosomu do prostych cząsteczek – aminokwasów, cukrów, kwasów tłuszczowych oraz nukleotydów. Produkty degradacji są następnie transportowane z powrotem do cytoplazmy, gdzie mogą zostać wykorzystane jako substraty w szlakach metabolicznych, m.in. w glukoneogenezie, cyklu Krebsa czy biosyntezie nowych białek.
Autofagia jest procesem kontrolowanym i odwracalnym. Gdy warunki środowiskowe ulegają poprawie, na przykład po przyjęciu pokarmu, wzrasta aktywność mTOR, co hamuje inicjację nowych autofagosomów. Jednocześnie komórka może selektywnie utrzymywać określony poziom degradacji, odpowiadający jej aktualnym potrzebom. Zaburzenia tej równowagi, zarówno w kierunku nadmiernej, jak i niewystarczającej aktywności, mogą mieć poważne konsekwencje dla funkcjonowania komórki i całego organizmu.
Szczególną odmianą jest mitofagia, czyli selektywna degradacja mitochondriów. Jej kluczowymi regulatorami są białka PINK1 i Parkin. Gdy mitochondrium zostaje uszkodzone i traci potencjał błonowy, PINK1 gromadzi się na jego powierzchni i rekrutuje Parkin, ligazę ubikwityny. Parkin ubikwitynuje liczne białka błonowe mitochondrium, co przyciąga białka adaptorowe i kieruje taki organell do autofagii. Mechanizm ten jest istotny m.in. w neuronach i ma znaczenie w patogenezie choroby Parkinsona.
Rola autofagii w zdrowiu, chorobach i starzeniu
Autofagia pełni wiele kluczowych funkcji w utrzymaniu zdrowia komórek i organizmu. Jedną z najważniejszych jest ochrona przed stresem. W sytuacjach niedoboru składników odżywczych, podczas infekcji, narażenia na toksyny czy stres oksydacyjny, aktywacja autofagii pozwala komórce przetrwać, dostarczając jej paliwa i usuwając uszkodzone komponenty. Dzięki temu ograniczane jest powstawanie reaktywnych form tlenu oraz nagromadzenie nieprawidłowych białek, które mogłyby wywołać kaskady śmierci komórkowej.
W kontekście starzenia autofagia jest jednym z najczęściej badanych mechanizmów związanych z długowiecznością. U wielu organizmów modelowych, takich jak drożdże, nicienie czy muszki owocowe, zwiększenie aktywności autofagii koreluje z wydłużeniem życia. Interwencje takie jak ograniczenie kaloryczne, post przerywany czy podawanie niektórych substancji farmakologicznych (np. rapamycyny) mogą nasilać autofagię i poprawiać parametry zdrowotne. Sugeruje to, że sprawny system autodegradacji jest jednym z warunków utrzymania funkcji komórek w miarę upływu czasu.
W miarę starzenia naturalna aktywność autofagii zwykle spada. Prowadzi to do powolnego gromadzenia uszkodzonych białek, agregatów i dysfunkcyjnych organelli, co obserwuje się szczególnie w komórkach o ograniczonej zdolności podziału, jak neurony czy kardiomiocyty. Zjawisko to wiąże się z rozwojem chorób neurodegeneracyjnych, takich jak choroba Alzheimera, Parkinsona czy Huntingtona. W każdym z tych schorzeń dochodzi do akumulacji patologicznych białek – beta-amyloidu, alfa-synukleiny czy zmutowanej huntingtyny – których prawidłowa degradacja zależy w znacznej mierze od efektywności autofagii.
Autofagia ma złożony, dwoisty związek z nowotworzeniem. Z jednej strony działa jako mechanizm supresji nowotworów, usuwając uszkodzone mitochondria i zapobiegając nadmiernej produkcji wolnych rodników tlenowych oraz uszkodzeniom DNA. Pomaga także eliminować onkogenne białka i utrzymywać stabilność genomu. Z drugiej strony, w już istniejących guzach, autofagia może wspierać przeżycie komórek nowotworowych w warunkach niedotlenienia, ograniczonego dopływu składników odżywczych czy podczas chemioterapii. Dlatego modulacja autofagii w onkologii wymaga bardzo przemyślanego podejścia, z uwzględnieniem typu i stadium nowotworu.
Istotną funkcją autofagii jest również udział w odpowiedzi immunologicznej. Komórki potrafią kierować do autofagii fragmenty patogenów – wirusów, bakterii czy pasożytów wewnątrzkomórkowych. Zjawisko to, nazywane czasem ksenofagią, umożliwia ich degradację oraz prezentację antygenów w kontekście cząsteczek MHC, co aktywuje swoistą odpowiedź odpornościową. Autofagia pomaga też regulować stan zapalny, m.in. przez kontrolę aktywności inflammasomu i degradację cytokin prozapalnych.
Nieprawidłowości w autofagii obserwuje się również w chorobach sercowo–naczyniowych. Zarówno nadmiernie nasilona, jak i zbyt słaba autofagia może być szkodliwa dla komórek mięśnia sercowego. W warunkach niedokrwienia, na przykład podczas zawału, umiarkowana aktywacja tego procesu bywa ochronna, ponieważ pozwala komórkom przejściowo utrzymać metabolizm. Jednak przewlekle nasilona autofagia może prowadzić do zbyt dużej utraty masy komórkowej i sprzyjać niewydolności serca. Zrozumienie tych subtelnych zależności jest jednym z wyzwań współczesnej kardiologii eksperymentalnej.
W chorobach metabolicznych, takich jak otyłość i cukrzyca typu 2, dochodzi do zaburzeń sygnalizacji insulinowej i przewlekłego stanu zapalnego w tkance tłuszczowej oraz wątrobie. Autofagia w komórkach tłuszczowych i hepatocytach odgrywa ważną rolę w regulacji gospodarki lipidowej, m.in. przez tzw. lipofagię, czyli degradację kropli tłuszczowych. Dysfunkcyjna autofagia może sprzyjać stłuszczeniu wątroby, insulinooporności i zaburzeniom profilu lipidowego, zwiększając ryzyko zespołu metabolicznego oraz powikłań naczyniowych.
Coraz więcej uwagi poświęca się również roli autofagii w komórkach macierzystych. Utrzymanie ich zdolności do samoodnowy i różnicowania wymaga skutecznego usuwania uszkodzonych mitochondriów i białek. Zaburzenia tych mechanizmów mogą przyspieszać wyczerpywanie puli komórek macierzystych szpiku, skóry czy jelit, co przekłada się na osłabienie regeneracji tkanek. W tym kontekście autofagia jawi się jako potencjalny cel interwencji mających na celu spowolnienie procesów starzenia narządowego.
Autofagia a dieta, styl życia i potencjalne terapie
Zainteresowanie autofagią wykracza poza laboratoria i przenika do dyskusji o diecie, stylu życia oraz strategiach profilaktyki chorób cywilizacyjnych. Jednym z najlepiej poznanych bodźców aktywujących autofagię jest ograniczenie kaloryczne. Zmniejszona podaż energii obniża sygnalizację insulinową i aktywność mTOR, a zwiększa aktywację AMPK, co prowadzi do nasilenia procesów degradacyjnych. Badania na zwierzętach wskazują, że przewlekłe, umiarkowane ograniczenie kalorii sprzyja wydłużeniu życia i opóźnia występowanie wielu chorób związanych z wiekiem.
Popularność zyskują różne formy postu przerywanego, w których okresy jedzenia przeplatają się z okresami bez przyjmowania pokarmu. W czasie głodówki poziom glukozy i insuliny spada, a organizm przechodzi na wykorzystywanie zapasów tłuszczowych i mechanizmów recyklingu komórkowego. Choć wyniki badań na ludziach są jeszcze niejednoznaczne i zależą od konkretnego protokołu, wiele danych sugeruje, że co najmniej kilkunastogodzinne przerwy między posiłkami mogą sprzyjać aktywacji autofagii w różnych tkankach.
Aktywność fizyczna to kolejny silny modulator autofagii. W mięśniach szkieletowych wysiłek wywołuje przemijający wzrost zapotrzebowania na energię, prowadząc do aktywacji AMPK i zwiększonej degradacji uszkodzonych białek oraz mitochondriów. Dzięki temu mięśnie zachowują sprawność, a ryzyko nagromadzenia dysfunkcyjnych struktur maleje. Ćwiczenia działają również na mięsień sercowy, nerki, wątrobę i tkankę tłuszczową, inicjując szereg adaptacji metabolicznych, w których autofagia odgrywa istotną rolę.
Na poziomie farmakologicznym naukowcy intensywnie badają substancje zdolne do modulowania autofagii. Przykładem jest rapamycyna, naturalny związek hamujący mTOR. W modelach zwierzęcych podawanie rapamycyny wydłuża życie i opóźnia pojawianie się objawów chorób związanych z wiekiem. Jednak długotrwałe stosowanie tej substancji u ludzi wiąże się z działaniami niepożądanymi, m.in. zaburzeniami odporności, dlatego jej potencjalne zastosowanie w profilaktyce starzenia wymaga szczególnej ostrożności.
Inne badane substancje to pochodne resweratrolu, spermidyna oraz niektóre leki przeciwcukrzycowe, jak metformina. Spermidyna, związek występujący m.in. w produktach roślinnych, może indukować autofagię przez wpływ na acetylację białek i regulację ekspresji genów ATG. Metformina z kolei aktywuje AMPK i pośrednio zmniejsza aktywność mTOR, co również sprzyja degradacji komórkowej. Choć wyniki badań przedklinicznych są obiecujące, nadal brakuje jednoznacznych danych z długoterminowych badań klinicznych, które potwierdziłyby bezpieczeństwo i skuteczność takich interwencji u ludzi zdrowych.
Należy podkreślić, że nadmierne lub niewłaściwe pobudzanie autofagii może być niekorzystne. Komórki potrzebują równowagi między syntezą a degradacją struktur. Zbyt intensywna autofagia może prowadzić do utraty kluczowych organelli, zaburzeń funkcjonowania błon i ostatecznie do śmierci komórki. Z tego względu interwencje mające na celu „maksymalizację” autofagii, oparte jedynie na modnych trendach, bez uwzględnienia indywidualnego stanu zdrowia, mogą okazać się ryzykowne.
Perspektywiczne zastosowania autofagii obejmują także terapię chorób neurodegeneracyjnych. Strategie polegające na dezintegracji agregatów białkowych przez zwiększenie aktywności systemu ATG są intensywnie testowane. Przykładowo, modulacja białek adaptorowych rozpoznających ubikwitynę lub zwiększanie ekspresji LC3 może usprawniać usuwanie patologicznych białek z neuronów. Podobnie w onkologii trwają badania nad łączeniem klasycznych chemioterapeutyków z inhibitorami autofagii, aby ograniczyć zdolność komórek nowotworowych do przetrwania w warunkach stresu terapeutycznego.
Interesujące są także potencjalne powiązania autofagii z mikrobiomem jelitowym. Bakterie jelitowe mogą wydzielać metabolity wpływające na szlaki sygnałowe gospodarza, w tym na aktywność mTOR i AMPK. Dieta bogata w błonnik, polifenole i niektóre kwasy tłuszczowe sprzyja wytwarzaniu krótkołańcuchowych kwasów tłuszczowych, takich jak maślan, które mogą pośrednio modulować procesy degradacyjne w nabłonku jelita. W ten sposób zachowana zostaje integralność bariery jelitowej oraz równowaga immunologiczna.
Zastosowanie wiedzy o autofagii w praktyce klinicznej wymaga jednak bardzo precyzyjnego podejścia. Terapie ukierunkowane na ten proces muszą brać pod uwagę typ tkanki, etap choroby, wiek pacjenta, a także współwystępowanie innych schorzeń. Naukowcy poszukują biomarkerów pozwalających ocenić poziom autofagii w konkretnych narządach, co mogłoby ułatwić personalizację leczenia. Równocześnie rozwijane są techniki obrazowania i narzędzia molekularne do śledzenia dynamicznych zmian w aktywności tego procesu w żywych organizmach.
Znaczenie autofagii dla przyszłości medycyny i nauk biologicznych
Odkrycie genów ATG u drożdży i opisanie ich odpowiedników u ssaków zapoczątkowało gwałtowny rozwój badań nad autofagią. Nagroda Nobla przyznana Yoshinoriemu Ohsumi za badania nad mechanizmami tego procesu podkreśliła jego fundamentalne znaczenie dla biologii komórki. Autofagia stała się jednym z centralnych pojęć w dyskusji o tym, jak komórki utrzymują równowagę wewnętrzną, reagują na stres i dostosowują się do zmieniających się warunków środowiskowych.
Współczesne techniki laboratoryjne, takie jak mikroskopia fluorescencyjna, cytometria przepływowa, proteomika czy edycja genomu metodą CRISPR, umożliwiają coraz dokładniejsze śledzenie i manipulowanie autofagią. Badacze mogą obserwować w czasie rzeczywistym tworzenie autofagosomów, oznaczając białka LC3 fluorescencyjnymi znacznikami, a następnie analizować ich kolokalizację z lizosomami. Z kolei zastosowanie myszy z precyzyjnymi mutacjami w genach ATG pozwala badać skutki upośledzenia autofagii w poszczególnych narządach.
Przyszłość badań nad autofagią wiąże się także z integracją danych z wielu poziomów organizacji biologicznej. Analizy transkryptomiczne, proteomiczne i metabolomiczne umożliwiają tworzenie modeli całych sieci regulacyjnych obejmujących mTOR, AMPK, insulinę, czynniki wzrostu, hormony steroidowe i szlaki stresu oksydacyjnego. Takie holistyczne podejście może pomóc zrozumieć, jak drobne zmiany w jednym z elementów układu wpływają na globalną równowagę między syntezą a degradacją struktur komórkowych.
W medycynie spersonalizowanej autofagia staje się obiecującym celem interwencji. U pacjentów z określonymi mutacjami w genach ATG lub regulatorach szlaków sygnałowych można rozważać terapię ukierunkowaną na przywrócenie prawidłowego poziomu degradacji komórkowej. Z drugiej strony, w niektórych przypadkach nowotworów czy chorób autoimmunologicznych korzystne może być czasowe zahamowanie autofagii w określonych komórkach. Kluczem pozostaje opracowanie leków działających selektywnie, minimalizujących skutki uboczne w tkankach zdrowych.
Istnieje również wyzwanie etyczne i społeczne związane z potencjalnym wykorzystaniem wiedzy o autofagii w kontekście przedłużania życia. Jeśli w przyszłości uda się opracować skuteczne i bezpieczne metody farmakologicznej modulacji tego procesu, pojawią się pytania o dostępność takich terapii, ich wpływ na strukturę demograficzną społeczeństw oraz na systemy ochrony zdrowia. Dyskusja ta wymaga współpracy biologów, lekarzy, filozofów, ekonomistów i decydentów politycznych.
W obszarze nauk podstawowych autofagia łączy się z wieloma innymi tematami, takimi jak programowana śmierć komórkowa, odpowiedź na stres, komunikacja międzykomórkowa, biologia mitochondriów czy regulacja cyklu komórkowego. Badania nad tym procesem dostarczają więc nie tylko wiedzy o jednym, izolowanym mechanizmie, lecz także pomagają budować całościowy obraz funkcjonowania żywych komórek. Dzięki temu lepiej rozumiemy, dlaczego niektóre organizmy potrafią długo zachowywać sprawność, a inne szybko ulegają degradacji w niesprzyjających warunkach.
Na styku biologii i technologii pojawiają się pomysły wykorzystania inspiracji autofagią w projektowaniu sztucznych systemów samonaprawiających się. Koncepcje teoretyczne zakładają tworzenie materiałów i urządzeń potrafiących identyfikować własne uszkodzone moduły, degradować je i zastępować nowymi, podobnie jak komórka usuwa wadliwe komponenty. Choć obecnie pozostaje to w sferze badań podstawowych, idea ta pokazuje, jak głęboko mechanizmy biologiczne mogą inspirować inżynierię i informatykę.
Znaczenie autofagii wykracza więc poza czysto biologiczne ciekawostki. To proces leżący u podstaw odporności komórek na stres, jakości białek, równowagi energetycznej i zdolności adaptacyjnych organizmu. Zrozumienie go w całej złożoności stanowi jedno z kluczowych wyzwań współczesnej nauki, a jednocześnie otwiera nowe możliwości dla medycyny, profilaktyki zdrowotnej oraz technologii inspirowanych naturą. W miarę postępu badań rola autofagii jako centralnego węzła w sieci procesów życiowych staje się coraz bardziej wyrazista, a potencjał jej wykorzystania – coraz większy.
FAQ – najczęstsze pytania o autofagię
Czy można „włączyć” autofagię samą dietą lub postem?
Autofagia jest wrażliwa na poziom składników odżywczych, dlatego post lub ograniczenie kalorii mogą ją nasilać. W okresie głodu spada aktywność szlaku mTOR, a rośnie aktywność AMPK, co sprzyja uruchomieniu procesów recyklingu komórkowego. Nie oznacza to jednak, że im dłuższy lub skrajniejszy post, tym lepiej – nadmierne restrykcje mogą prowadzić do utraty masy mięśniowej, zaburzeń hormonalnych i osłabienia odporności. Skutki zależą od wieku, stanu zdrowia, leków i poziomu aktywności fizycznej, dlatego dłuższe lub częste posty powinny być planowane ostrożnie i najlepiej po konsultacji ze specjalistą.
Jaki związek ma autofagia ze starzeniem się organizmu?
Wraz z wiekiem naturalna aktywność autofagii zwykle maleje, przez co komórki gorzej usuwają uszkodzone białka i organella. Prowadzi to do narastania stresu oksydacyjnego, zaburzeń metabolizmu i zwiększonej podatności na choroby związane z wiekiem, takie jak neurodegeneracje, nowotwory czy niewydolność serca. W modelach zwierzęcych interwencje wzmacniające autofagię, na przykład umiarkowane ograniczenie kalorii, post przerywany lub niektóre leki hamujące mTOR, wiążą się z wydłużeniem życia i poprawą jego jakości. U ludzi dane są bardziej złożone, ale rośnie liczba dowodów, że utrzymanie sprawnych mechanizmów degradacji komórkowej stanowi ważny element zdrowego starzenia.
Czy zaburzenia autofagii mogą powodować choroby neurologiczne?
Zaburzenia autofagii są ściśle powiązane z wieloma chorobami układu nerwowego. Neurony, jako komórki długowieczne, szczególnie polegają na sprawnym usuwaniu uszkodzonych białek i mitochondriów. Gdy autofagia jest upośledzona, dochodzi do nagromadzenia toksycznych agregatów, takich jak beta-amyloid, fosforylowane tau czy alfa-synukleina. Zjawisko to obserwuje się m.in. w chorobie Alzheimera, Parkinsona i innych otępieniach. Badania na modelach zwierzęcych pokazują, że wzmocnienie autofagii potrafi ograniczać odkładanie patologicznych białek i spowalniać degenerację neuronów. Wciąż trwają jednak prace nad bezpiecznymi terapiami dla ludzi, gdyż nadmierna aktywacja degradacji także może szkodzić delikatnym strukturom mózgowym.
Czym różni się autofagia od apoptozy i czy mogą zachodzić jednocześnie?
Autofagia i apoptoza to dwa odmienne, choć powiązane procesy. Autofagia jest mechanizmem recyklingu i adaptacji – pozwala komórce przetrwać stres, usuwając uszkodzone elementy i odzyskując z nich składniki. Apoptoza natomiast to programowana śmierć komórki, uruchamiana, gdy uszkodzenia są zbyt poważne lub gdy komórka jest zbędna dla organizmu. W wielu sytuacjach umiarkowana aktywność autofagii działa ochronnie i opóźnia wejście w apoptozę. Jednak przy ciężkim stresie te same szlaki sygnałowe mogą przełączyć się na program śmierci komórkowej. Co więcej, niektóre białka regulacyjne uczestniczą zarówno w autofagii, jak i apoptozie, tworząc złożoną sieć decyzyjną o losie komórki.