Centriola to mikroskopijna struktura wewnątrz komórki eukariotycznej, której istnienie przez długi czas wydawało się jedynie ciekawostką morfologiczną, a dziś uznawane jest za kluczowe dla zrozumienia organizacji cytoszkieletu, podziałów komórkowych i ruchu rzęsek. Jej precyzyjna budowa, niezwykła stabilność oraz zdolność do replikacji czynią z niej modelowy przykład tego, jak złożone mogą być wewnętrzne elementy komórki, mimo że zbudowane są z zaledwie kilku typów białek. Zrozumienie roli centrioli pozwala lepiej wyjaśnić mechanizmy rozwoju zarodkowego, nowotworzenia i chorób genetycznych związanych z tzw. ciliopatiami.
Budowa i ultrastruktura centrioli
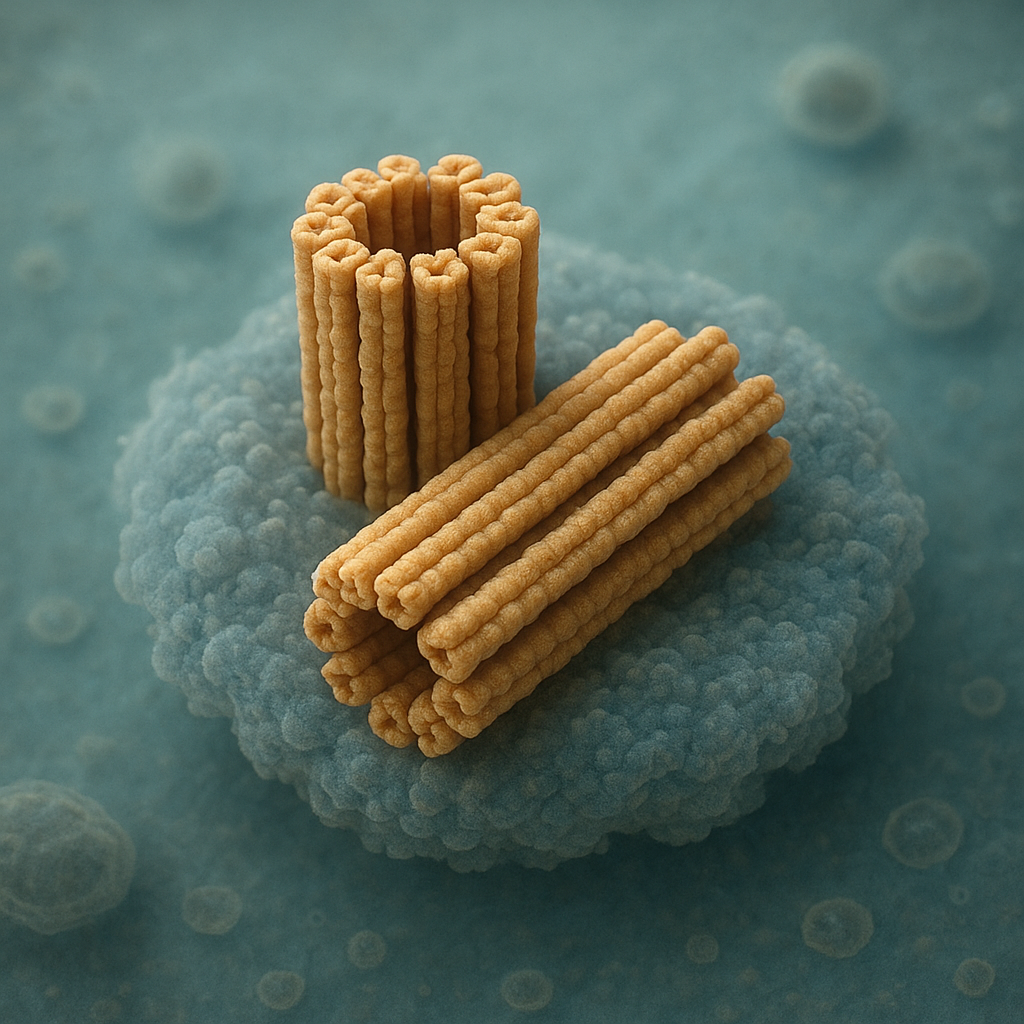
Centriola ma zwykle postać krótkiego, cylindrycznego walca o długości około 0,2–0,5 μm i średnicy bliskiej 0,2 μm. Jej ściana zbudowana jest z dziewięciu zestawów mikrotubul ułożonych koncentrycznie na obwodzie. Każdy taki zestaw, zwany tripletowym, składa się z trzech ściśle przylegających do siebie mikrotubul oznaczanych jako A, B i C. To klasyczny schemat 9+0, który odróżnia centriolę od rzęsek i wici posiadających układ 9+2 z dodatkowymi mikrotubulami centralnymi.
Otoczenie centrioli tworzy tzw. macierz pericentriolowa, pozbawiona typowej błony, ale bogata w białka odpowiedzialne za nukleację mikrotubul. Wśród nich kluczową rolę odgrywa kompleks γ-TuRC zawierający γ-tubulinę. To właśnie w tej strefie formowane są nowe mikrotubule tworzące promieniste włókna wrzeciona podziałowego oraz szkielet transportowy dla organelli i pęcherzyków. Centriola pełni więc funkcję wyspecjalizowanego centrum organizacji mikrotubul, czyli centrosomu, gdy występuje w parze z bliźniaczą strukturą.
Charakterystyczne jest istnienie dwóch rodzajów centrioli: matczynej i potomnej. Matczyna centriola posiada tzw. wyrostki dystalne i poddystalne, które umożliwiają zakotwiczenie rzęsek i wici w błonie komórkowej. Potomna centriola tych wyrostków początkowo nie ma, nabywa je dopiero w kolejnym cyklu komórkowym. Ta asymetria między centriolami ma znaczące konsekwencje dla funkcjonowania komórki, m.in. dla powstawania podstawy rzęski, która inicjuje powstanie struktury zwanej ciałkiem podstawnym.
Pod względem białkowym centriole są zaskakująco konserwatywne ewolucyjnie. W ich skład wchodzą takie białka jak centryna, CEP135, SAS-6 czy STIL, odpowiedzialne za inicjację i stabilizację pierścienia dziewięciu tripletów mikrotubul. Uszkodzenia genów kodujących te białka prowadzą do poważnych defektów w liczbie, kształcie i funkcji centrioli, a co za tym idzie – do zaburzeń całego cyklu komórkowego.
Interesujące jest to, że choć centriole nie są otoczone błoną, zachowują się jak zorganizowany moduł strukturalny. Ich cylinder mikrotubul tworzy swoistą „rusztowaniową” platformę, do której przyłączają się liczne cząsteczki białkowe i kompleksy regulacyjne. Dzięki temu możliwe jest zarówno przekazywanie sygnałów, jak i mechaniczne oddziaływanie na otaczający cytoplazmatyczny szkielet komórki.
Cykl życiowy centrioli i ich funkcje w komórce
Centriola nie jest strukturą statyczną – podlega ściśle kontrolowanemu cyklowi duplikacji powiązanemu z cyklem komórkowym. W każdej komórce zwierzęcej znajdują się zwykle dwie centriole, ustawione względem siebie niemal pod kątem prostym. Ten duet tworzy centrosom, który w fazie G1 i wczesnej S cyklu komórkowego inicjuje powstanie nowych, potomnych centrioli. Proces duplikacji rozpoczyna się z chwilą, gdy przy bokach matczynych centrioli pojawiają się krótkie, dziewięciopromienne struktury zwane kartezjuszami proksymalnymi, zbudowane m.in. z białka SAS-6.
W trakcie fazy S i G2 centriole wydłużają się i dojrzewają, a ich wzajemne połączenie jest sukcesywnie osłabiane przez kontrolowane aktywności kinaz, takich jak Plk1. W efekcie, na początku mitozy komórka dysponuje dwoma oddalonymi od siebie centrosomami, z których każdy zawiera parę centrioli – jedną matczyną i jedną potomną. To rozdzielenie centrów organizacji mikrotubul jest niezbędne do wytworzenia dwubiegunowego wrzeciona mitotycznego, które kieruje ruchem chromosomów w trakcie metafazy i anafazy.
Jedną z kluczowych ról centrioli jest właśnie organizowanie mikrotubul wrzeciona podziałowego. Mikrotubule te wyrastają promieniście z macierzy pericentriolowej, a ich końce dodatnie poszukują kinetochorów – specyficznych struktur białkowych na chromosomach. Poprawne przyłączenie gwarantuje równomierny rozdział materiału genetycznego między komórki potomne. Zaburzenia liczby lub pozycji centrioli prowadzą do powstania wrzeciona wielobiegunowego, co zwiększa ryzyko nierównomiernego podziału chromosomów i powstawania aneuploidii, zjawiska typowego dla wielu nowotworów.
Równie ważną funkcją centrioli jest udział w tworzeniu rzęsek i wici. Gdy komórka wychodzi z cyklu podziałowego i wchodzi w fazę spoczynkową (G0) lub specjalizuje się, jedna z centrioli – zwykle matczyna – migruje ku powierzchni komórki i zakotwicza się w błonie plazmatycznej. Tam przekształca się w ciałko podstawne, od którego zaczynają wyrastać mikrotubule aksonemy rzęski. To przejście z roli centrum organizacji mikrotubul w cytoplazmie do roli fundamentu rzęski jest przykładem plastyczności funkcjonalnej centrioli.
Rzęski nieruchome, zwane też pierwotnymi, pełnią funkcje czujników mechanicznych i chemicznych, reagując na przepływ płynu, stężenia jonów lub obecność cząsteczek sygnałowych. Rzęski ruchome i wici z kolei generują przepływ medium – np. śluzu w drogach oddechowych – albo umożliwiają lokomocję pojedynczych komórek, czego klasycznym przykładem jest plemnik. W każdym z tych przypadków centriole startują jako wzorzec organizacyjny, determinujący liczbę i orientację rzęsek oraz ich poprawne zakotwiczenie.
Oprócz funkcji strukturalnych centriole uczestniczą w organizacji przestrzennej całej komórki. Położenie centrosomu często koreluje z kierunkiem ruchu komórki, polaryzacją komórkową i miejscem formowania wypustek, takich jak aksony u neuronów. Z tego powodu centriole postrzegane są nie tylko jako statyczne „kotwice” mikrotubul, lecz także jako dynamiczne centra integrujące informacje mechaniczne i sygnałowe na poziomie całej komórki.
Centriole w rozwoju organizmu, ewolucji i chorobach
Rola centrioli wykracza daleko poza pojedynczą komórkę. W rozwoju zarodkowym wielu organizmów, w tym kręgowców, prawidłowe działanie centrioli jest niezbędne dla symetrii ciała, rozmieszczenia narządów oraz funkcjonowania układu nerwowego. Przykładem jest wyznaczanie osi lewo–prawo podczas gastrulacji u kręgowców, gdzie ruchome rzęski, bazujące na prawidłowo uformowanych centriolach, generują kierunkowy przepływ płynu w obrębie węzła zarodkowego. Zakłócenia w tym procesie prowadzą do zaburzeń lateralizacji i anatomicznych wad położenia narządów.
W wielu tkankach występuje ścisły związek między cyklem komórkowym a budową rzęsek. Gdy komórka przygotowuje się do podziału, rzęska zostaje zdepolimeryzowana, a matczyna centriola wraca do pełnienia roli składnika centrosomu. Wraz z zakończeniem mitozy i wejściem komórki w stan różnicowania ponownie może zostać użyta jako ciałko podstawne. Ta naprzemienna funkcja centrioli wymaga precyzyjnej regulacji liczby i aktywności tych struktur, co czyni je podatnymi na zaburzenia genetyczne i środowiskowe.
Na poziomie ewolucyjnym centriole i pokrewne im ciałka podstawne występują u większości eukariontów, choć istnieją organizmy, które je utraciły lub znacznie uprościły. W komórkach roślin wyższych klasyczny centrosom z centriolami praktycznie nie występuje, a funkcję organizacji mikrotubul pełnią inne struktury rozsiane w cytoplazmie. Pomimo tego, analizy porównawcze genomów wskazują, że wiele białek typowych dla centrioli jest konserwowanych także u roślin, co sugeruje wspólne pochodzenie tych mechanizmów u przodka wszystkich eukariontów.
W świecie protistów centriole przybierają niekiedy złożone formy, tworząc rozbudowane aparaty korzonkowe rzęsek, które determinują geometryczne rozmieszczenie narządów ruchu. U niektórych wiciowców aparaty te sterują sposobem poruszania się i pływania, co wpływa na ekologiczne nisze zajmowane przez te organizmy. Wskazuje to, że centriole nie są jedynie „standardowym” elementem komórki zwierzęcej, ale modułem wykorzystywanym w różnorodny sposób w zależności od potrzeb danego gatunku.
W medycynie centriole stały się przedmiotem intensywnych badań z powodu ich związku z chorobami zwanymi ciliopatiami. Są to schorzenia wynikające z wadliwej budowy lub funkcjonowania rzęsek i wici, a tym samym również ciałek podstawnych i centrioli. Należą do nich m.in. zespół Bardeta–Biedla, zespół Jouberta, policystyczna choroba nerek, niektóre postacie retinopatii barwnikowej, a także pierwotna dyskineza rzęsek. Objawy tych chorób są niezwykle zróżnicowane: od zaburzeń rozwoju mózgu, przez ślepotę, otyłość, bezpłodność, aż po niewydolność oddechową.
Inną grupą zaburzeń, w których centriole odgrywają znaczącą rolę, są nowotwory. W komórkach wielu guzów obserwuje się nadliczbowe centriole, prowadzące do tworzenia wielobiegunowego wrzeciona mitotycznego. Komórki nowotworowe często jednak potrafią „naprawić” taką sytuację poprzez mechanizm klastrowania centrów organizacji mikrotubul, co pozwala im mimo wszystko dzielić się względnie prawidłowo. To otwiera perspektywę terapeutyczną: leki, które zakłócałyby klastrowanie, mogłyby prowadzić do katastrofalnych błędów mitotycznych i śmierci komórek nowotworowych.
Zbadano także związek mutacji w białkach centriolarnych z pierwotną małogłowiem (mikrocefalią). U osób dotkniętych tym schorzeniem mózg jest znacznie mniejszy niż przeciętnie, co wynika z zaburzeń podziałów progenitorowych komórek nerwowych. Okazuje się, że precyzyjna liczba i prawidłowa pozycja centrioli w komórkach nerwowych jest kluczowa dla właściwego przebiegu neurogenezy i wzrostu kory mózgowej. W ten sposób mikroskopijne struktury centriolalne mają wpływ na makroskalową architekturę całego układu nerwowego.
Nowoczesne techniki mikroskopii, takie jak mikroskopia superrozdzielcza czy kriomikroskopia elektronowa, pozwoliły ujawnić kolejne poziomy organizacji wewnętrznej centrioli. Odkryto m.in. spiralne i pierścieniowe układy białek w obrębie tripletów mikrotubul oraz ich powiązania z wewnętrznymi mostkami i filamentami. Pozwoliło to na tworzenie coraz dokładniejszych modeli komputerowych, które symulują, jak niewielkie zmiany w składzie białkowym mogą prowadzić do deformacji całej struktury i w konsekwencji do choroby.
Ciekawym kierunkiem badań jest także potencjalne wykorzystanie zasad organizacji centrioli w nanotechnologii i inżynierii biomimetycznej. Koncepcja cylindrycznych struktur samoskładających się z powtarzalnych modułów białkowych może inspirować projektowanie nano–rusztowań, kanałów czy wirników o średnicy rzędu dziesiątek nanometrów. Analiza sposobu, w jaki komórka kontroluje liczbę i położenie takich „nanocylindrów”, może dostarczyć wskazówek do regulacji sztucznych systemów samoorganizujących się.
Pomimo ogromnego postępu w badaniach, wiele zagadek dotyczących centrioli pozostaje nierozwiązanych. Wciąż nie w pełni rozumiemy, jak dokładnie inicjowany jest pierwszy szablon dziewięciu promieni SAS-6, jak komórka liczy swoje centriole i w jaki sposób sygnały z zewnątrz – na przykład mechaniczne odkształcenia komórki – są integrowane z wewnętrznymi programami duplikacji. Niewykluczone, że odpowiedzi na te pytania ujawnią kolejne, nieznane dotąd powiązania między organizacją cytoszkieletu a kontrolą losów komórkowych w trakcie rozwoju, starzenia i choroby.
Znaczenie centrioli dla badań biologicznych i przyszłych terapii
Zrozumienie biologii centrioli ma istotne znaczenie nie tylko dla nauk podstawowych, ale i dla przyszłych zastosowań klinicznych. Ze względu na swój udział w kontrolowaniu podziałów komórkowych, centriole stają się potencjalnym celem nowych leków przeciwnowotworowych. Inhibitory kinaz regulujących dojrzewanie i rozdział centrioli są już przedmiotem intensywnych badań przedklinicznych. Kluczowe jest jednak dostateczne rozróżnienie między procesami zachodzącymi w komórkach nowotworowych a fizjologicznymi podziałami w tkankach szybko odnowy, takich jak szpik kostny czy nabłonki przewodu pokarmowego.
W ramach medycyny precyzyjnej coraz częściej analizuje się profile mutacji w genach kodujących białka centriol i rzęsek u pacjentów z niewyjaśnionymi wcześniej zespołami wielonarządowymi. Rozpoznanie, że dana choroba jest skutkiem defektu centriol, zmienia sposób jej klasyfikacji i otwiera drogę do specyficznej diagnostyki molekularnej. W przyszłości możliwe mogą stać się terapie ukierunkowane na przywracanie prawidłowej funkcji rzęsek, czy to przez modyfikacje genetyczne, czy farmakologiczne wpływanie na skład i stabilność mikrotubul.
Znajomość mechanizmów działania centrioli ma również znaczenie dla biologii rozrodu. Plemnik wnosi do zygoty centriolę, która często staje się punktem wyjścia dla organizacji pierwszego wrzeciona podziałowego zarodka. Zaburzenia budowy centrioli plemnikowej mogą prowadzić do nieprawidłowych podziałów po zapłodnieniu i wczesnych poronień. Dlatego badania struktury i liczby centrioli w gametach są rozwijanym kierunkiem diagnostyki niepłodności.
Wreszcie, centriole stanowią doskonały model badawczy do studiowania ogólniejszych zjawisk biologicznych: samoorganizacji struktur komórkowych, precyzyjnego czasowania cyklu życiowego organelli czy koordynacji między procesami mechaniczno–strukturalnymi a sygnalizacją molekularną. Zdolność komórki do tworzenia, liczenia i dziedziczenia tak złożonych, a jednocześnie regularnych struktur, jakimi są cylindryczne walce złożone z dziewięciu symetrycznie rozmieszczonych tripletów mikrotubul, stanowi fascynujące wyzwanie dla współczesnej biologii systemowej.
W miarę rozwoju technik obrazowania, edycji genomu oraz biologii obliczeniowej będziemy mogli coraz dokładniej odtwarzać historię każdej pojedynczej centrioli – od jej zainicjowania przy matczynej strukturze, przez kolejne cykle dojrzewania, aż po jej udział w formowaniu rzęsek, podziałach komórkowych i ewentualnej degradacji. Integracja tych danych z informacją o stanie całej komórki i otaczającej ją tkanki pozwoli pełniej zrozumieć, w jaki sposób niewielkie, cylindryczne organelle mogą mieć tak szeroki wpływ na funkcjonowanie całego organizmu.
FAQ – najczęściej zadawane pytania o centriolę
Co to jest centriole i gdzie występuje w komórce?
Centriola to niewielka cylindryczna struktura zbudowana z dziewięciu tripletów mikrotubul ułożonych koncentrycznie. Występuje w komórkach eukariotycznych, przede wszystkim zwierzęcych i wielu protistów. Zwykle tworzy parę z drugą centriolą, a razem stanowią centrum organizacji mikrotubul, zwane centrosomem. Taki duet zlokalizowany jest w pobliżu jądra komórkowego i odgrywa kluczową rolę w podziałach komórkowych oraz w tworzeniu rzęsek.
Jaką rolę pełni centriole w podziale komórki?
Podczas cyklu komórkowego centriole ulegają duplikacji, dzięki czemu komórka wchodząca w mitozę posiada dwa oddzielone od siebie centrosomy. Każdy z nich organizuje promienisty układ mikrotubul tworzących wrzeciono podziałowe. Wrzeciono przyłącza się do chromosomów i umożliwia ich równomierne rozdzielenie do komórek potomnych. Jeżeli liczba lub położenie centrioli są zaburzone, może dojść do błędnego rozdziału chromosomów i powstania genomowej niestabilności.
Jaki jest związek centrioli z rzęskami i wiciami?
Jedna z centrioli, najczęściej matczyna, może przekształcić się w tzw. ciałko podstawne, które zakotwicza się w błonie komórkowej. Od tego ciałka wyrastają mikrotubule tworzące aksonemę rzęski lub wici. Tym samym centriole wyznaczają nie tylko miejsce, ale także orientację rzęsek. Dotyczy to zarówno rzęsek ruchomych, biorących udział w transporcie śluzu czy poruszaniu komórki, jak i nieruchomych rzęsek pierwotnych, pełniących funkcje czujników mechanicznych i chemicznych.
Dlaczego uszkodzenia centrioli prowadzą do chorób?
Defekty białek budujących centriolę zaburzają jej liczbę, kształt lub zdolność do tworzenia rzęsek. Skutkuje to niewłaściwym działaniem rzęsek ruchomych i pierwotnych, co prowadzi do tzw. ciliopatii. Mogą one objawiać się zaburzeniami rozwoju mózgu, anomaliami położenia narządów, uszkodzeniem nerek, ślepotą czy niewydolnością oddechową. Ponadto nadliczbowe centriole sprzyjają powstawaniu niestabilności genomowej, typowej dla wielu nowotworów, co łączy te organelle z procesem transformacji nowotworowej.