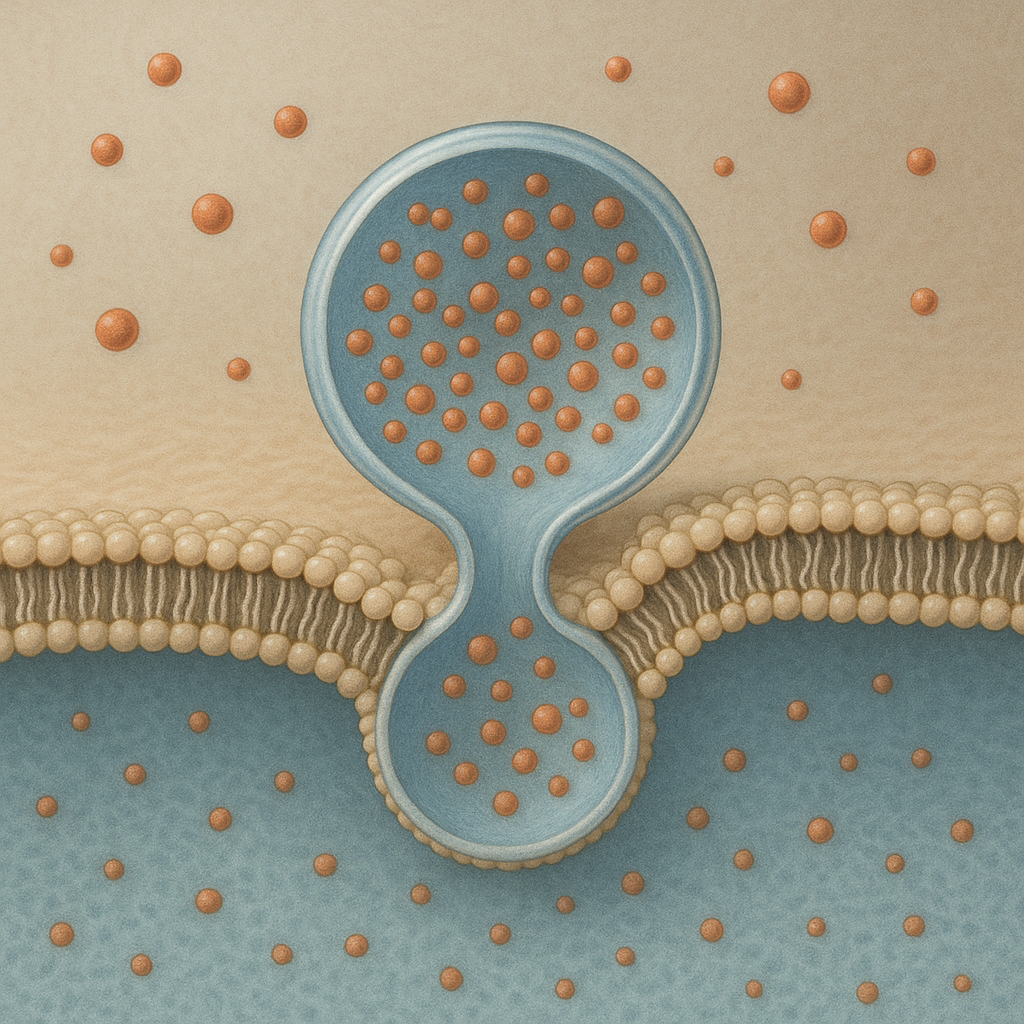
Egzocytoza to jeden z kluczowych procesów życiowych komórek, dzięki któremu możliwe jest usuwanie substancji na zewnątrz oraz komunikacja z innymi komórkami. Bez tego mechanizmu trudno wyobrazić sobie funkcjonowanie układu nerwowego, odpornościowego czy gospodarki hormonalnej. Zrozumienie egzocytozy pozwala wyjaśnić, w jaki sposób komórki regulują swoje środowisko, przekazują sygnały i bronią się przed zagrożeniami, stanowiąc fundament współczesnej biologii komórki oraz medycyny eksperymentalnej.
Podstawy egzocytozy – definicja, znaczenie i rodzaje
Egzocytoza to proces, w którym komórka transportuje cząsteczki z wnętrza na zewnątrz za pomocą pęcherzyków błonowych. Pęcherzyki te powstają najczęściej w aparacie Golgiego lub w endosomach, a następnie przemieszczają się do błony komórkowej, gdzie ich błona zlewa się z błoną komórki, uwalniając zawartość do przestrzeni zewnątrzkomórkowej. Proces ten jest jednym z głównych mechanizmów tzw. transportu pęcherzykowego i ma ogromne znaczenie dla utrzymania homeostazy.
Kluczową cechą egzocytozy jest jej kierunkowość: substancje przemieszczają się z cytoplazmy na zewnątrz komórki. Może to dotyczyć zarówno małych cząsteczek, jak hormony, neuroprzekaźniki czy neuropeptydy, jak i dużych agregatów białkowych czy składników macierzy zewnątrzkomórkowej. Komórka nie tylko pozbywa się w ten sposób zbędnych produktów, ale przede wszystkim aktywnie oddziałuje na inne komórki i tkanki, tworząc złożoną sieć sygnałów chemicznych.
Egzocytoza pełni kilka zasadniczych funkcji:
- sekrecja hormonów i neuroprzekaźników – umożliwia komunikację międzykomórkową, szczególnie w układzie nerwowym i dokrewnym,
- usuwanie produktów przemiany materii i toksyn – ważny element utrzymania homeostazy komórkowej,
- remodelowanie i powiększanie błony komórkowej – udział w wzroście komórki i procesach naprawczych,
- wydzielanie enzymów trawiennych i składników macierzy – kluczowe dla trawienia zewnątrzkomórkowego i budowy tkanek,
- prezentacja antygenów i odpowiedź immunologiczna – istotna rola w aktywacji komórek układu odpornościowego.
W praktyce biologicznej wyróżnia się kilka typów egzocytozy, różniących się przebiegiem i regulacją:
Egzocytoza konstytutywna
Egzocytoza konstytutywna to proces zachodzący w sposób ciągły, niezależny od gwałtownych bodźców zewnętrznych. Każda komórka eukariotyczna wykorzystuje ją do stałego odnawiania swojej błony oraz do wydzielania określonych substancji, takich jak składniki macierzy zewnątrzkomórkowej czy niektóre białka osocza. Ten typ egzocytozy zapewnia stabilny poziom wymiany między wnętrzem komórki a jej otoczeniem, a jego zaburzenia mogą prowadzić do poważnych defektów strukturalnych tkanek.
Egzocytoza regulowana
Egzocytoza regulowana występuje głównie w wyspecjalizowanych komórkach wydzielniczych, na przykład w neuronach, komórkach trzustki czy komórkach endokrynnych. Pęcherzyki z substancjami są w nich magazynowane w pobliżu błony komórkowej i czekają na sygnał – najczęściej jest nim gwałtowny wzrost stężenia jonów wapnia w cytoplazmie. Po pojawieniu się bodźca pęcherzyki szybko ulegają fuzji z błoną, uwalniając zawartość. Ten mechanizm zapewnia dużą szybkość reakcji, co jest niezbędne np. w transmisji synaptycznej.
Egzocytoza lizosomalna i naprawcza
Specyficzną formą egzocytozy jest uwalnianie zawartości lizosomów lub innych przedziałów degradacyjnych do przestrzeni zewnątrzkomórkowej. Umożliwia to usuwanie niestrawionych resztek, ale także uczestniczy w naprawie błony. Gdy błona komórkowa ulega uszkodzeniu, pęcherzyki lizosomalne mogą szybko z nią fuzjować, dostarczając dodatkowej powierzchni i enzymów wspomagających proces gojenia. Ten typ egzocytozy odgrywa ważną rolę w komórkach narażonych na działanie mechaniczne, takich jak komórki mięśniowe czy nabłonkowe.
Mechanizm molekularny egzocytozy – od pęcherzyka do fuzji błon
Proces egzocytozy jest precyzyjnie kontrolowany na poziomie molekularnym. Jego przebieg można podzielić na kilka etapów: powstanie pęcherzyka, jego transport do błony komórkowej, dokowanie, pierwotne przytwierdzenie, a następnie fuzja i uwolnienie ładunku. Każdy z tych kroków jest regulowany przez liczne białka, lipidy i sygnały wewnątrzkomórkowe.
Powstawanie pęcherzyków transportowych
Pęcherzyki transportowe formują się zazwyczaj w aparacie Golgiego lub w endosomach. Błona tych organelli wpukla się, otaczając transportowane białka i inne cząsteczki. Kluczową rolę pełnią tu białka powłokowe, takie jak COPI, COPII czy klatryna, które pomagają modelować kształt pęcherzyka i selekcjonować jego zawartość. Po oderwaniu się od błony macierzystej pęcherzyk traci płaszcz białkowy i staje się gotowy do dalszego transportu w cytoplazmie.
Warto podkreślić, że sortowanie białek do pęcherzyków jest procesem niezwykle selektywnym. Komórka wykorzystuje sekwencje sygnałowe w strukturze białek, które rozpoznają specyficzne receptory sortujące. Dzięki temu do przestrzeni zewnątrzkomórkowej trafiają właściwe zestawy cząsteczek, a inne pozostają w odpowiednich przedziałach komórki. Błędne sortowanie może prowadzić do chorób spichrzeniowych, defektów wydzielania hormonów lub zaburzeń rozwoju tkanek.
Transport pęcherzyków i rola cytoszkieletu
Po uformowaniu pęcherzyk musi zostać dostarczony do błony komórkowej. W tym etapie kluczową rolę odgrywa cytoszkielet – sieć mikrotubul i filamentów aktynowych, po których „poruszają się” pęcherzyki dzięki białkom motorycznym. Kinezyny i dyneiny poruszają się wzdłuż mikrotubul, transportując ładunek w kierunku odpowiednich biegunów komórki, natomiast miozyny wykorzystują filamenty aktynowe dla ruchów bardziej precyzyjnych, szczególnie w pobliżu błony.
Transport pęcherzyków nie jest procesem chaotycznym – jest sterowany przez układ małych białek G, takich jak Rab, które działają jak „kody pocztowe”. Konkretne formy Rab przyłączone do błony pęcherzyka rozpoznają określone regiony błony komórkowej, co zapewnia trafienie pęcherzyka we właściwe miejsce. To zróżnicowanie jest szczególnie istotne w komórkach spolaryzowanych, np. w neuronach, gdzie część pęcherzyków musi dotrzeć do aksonu, inne zaś do dendrytów.
Dokowanie pęcherzyka i kompleks SNARE
Po dotarciu do błony pęcherzykowej rozpoczyna się etap dokowania. Błona pęcherzyka zawiera specyficzne białka SNARE, określane jako v-SNARE (vesicle-SNARE), natomiast błona komórkowa ma swoje t-SNARE (target-SNARE). Wzajemne rozpoznanie i związanie tych białek prowadzi do utworzenia stabilnego kompleksu, który zbliża do siebie obie błony.
Kompleks SNARE jest podstawowym elementem mechanizmu fuzji. Tworzy on rodzaj „zamka błyskawicznego”, który, stopniowo zacieśniając swoje oddziaływania, zmniejsza odległość między dwoma warstwami lipidowymi. Dzięki temu energetyczna bariera fuzji ulega obniżeniu, a warstwy mogą się połączyć, tworząc przejściowy por, przez który wydzielana jest zawartość pęcherzyka. Prawidłowe działanie kompleksu SNARE jest regulowane m.in. przez białka SM, synaptotagminy i inne czynniki modulujące czułość na jony wapnia.
Rola jonów wapnia i sygnałów wewnątrzkomórkowych
W egzocytozie regulowanej, np. w synapsach nerwowych, kluczowym sygnałem wyzwalającym fuzję jest nagły wzrost stężenia Ca²⁺ w pobliżu błony. Jony wapnia wiążą się z białkami czujnikowymi, takimi jak synaptotagmina, co powoduje gwałtowne przyśpieszenie końcowej fazy fuzji. Ta zależność od Ca²⁺ umożliwia precyzyjne sterowanie momentem wydzielania neuroprzekaźników, co jest niezbędne dla sprawnej komunikacji między neuronami.
Oprócz Ca²⁺ w regulacji egzocytozy uczestniczą także inne szlaki sygnałowe, np. z udziałem kinaz białkowych, cAMP czy fosfatydyloinozytoli. Modyfikacje potranslacyjne elementów kompleksu SNARE lub innych białek uczestniczących w egzocytozie mogą zwiększać bądź zmniejszać częstość fuzji, dostosowując działanie komórki do aktualnych warunków środowiska zewnętrznego i wewnętrznego.
Fuzja pełna i egzocytoza typu „kiss-and-run”
Gdy pęcherzyk połączy się z błoną komórkową, może dojść do dwóch głównych scenariuszy. W przypadku fuzji pełnej błony całkowicie się zlewają, a błona pęcherzyka staje się częścią błony komórki. Zawartość pęcherzyka jest wówczas całkowicie uwalniana. Mechanizm ten jest typowy dla wielu komórek sekrecyjnych i przyczynia się również do zwiększenia powierzchni błony.
Alternatywą jest egzocytoza typu „kiss-and-run”, w której pęcherzyk jedynie chwilowo tworzy por z błoną, uwalniając część ładunku, po czym odłącza się z powrotem do cytoplazmy. Taki mechanizm pozwala na precyzyjne dozowanie ilości wydzielanej substancji oraz umożliwia szybszy recykling pęcherzyków. Jest szczególnie ważny w synapsach, gdzie konieczne jest wielokrotne, szybkie wydzielanie neuroprzekaźników przy minimalnym koszcie energetycznym.
Egzocytoza w funkcjonowaniu organizmu – przykłady i znaczenie kliniczne
Znaczenie egzocytozy najlepiej zrozumieć, analizując jej udział w konkretnych układach i narządach. Proces ten jest obecny praktycznie we wszystkich tkankach, lecz szczególną rolę odgrywa w komunikacji nerwowej, hormonalnej, w reakcjach immunologicznych oraz w przebiegu licznych chorób. Zaburzenia egzocytozy mogą prowadzić do poważnych konsekwencji klinicznych, w tym do schorzeń neurodegeneracyjnych, zaburzeń metabolicznych czy patologii nowotworowych.
Egzocytoza w układzie nerwowym
W neuronach egzocytoza jest podstawą przekazywania sygnałów między komórkami. W zakończeniach aksonów znajdują się pęcherzyki synaptyczne wypełnione neuroprzekaźnikami, takimi jak acetylocholina, glutaminian czy GABA. Po nadejściu potencjału czynnościowego następuje otwarcie kanałów wapniowych, napływ Ca²⁺ i szybka egzocytoza pęcherzyków do szczeliny synaptycznej.
Neuroprzekaźniki dyfundują w szczelinie i wiążą się z receptorami na komórce postsynaptycznej, wywołując odpowiedź elektryczną lub biochemiczną. Sprawność tego procesu zależy od prawidłowej organizacji stref aktywnych, recyklingu pęcherzyków oraz precyzyjnej regulacji przez białka synaptyczne. Wiele toksyn i leków działa właśnie poprzez modulację egzocytozy w synapsach, np. toksyna botulinowa hamuje wydzielanie acetylocholiny, co prowadzi do porażenia mięśni.
Egzocytoza hormonów i regulacja metabolizmu
Komórki dokrewne, takie jak komórki β trzustki, wykorzystują egzocytozę do wydzielania hormonów do krwi. Insulina, odpowiedzialna za kontrolę poziomu glukozy, jest magazynowana w ziarnistościach wydzielniczych, które ulegają fuzji z błoną po wzroście stężenia glukozy we krwi. Zakłócenia w tym procesie mogą prowadzić do cukrzycy typu 2, w której komórki trzustki nie wydzielają wystarczającej ilości insuliny, mimo jej produkcji.
Podobne mechanizmy dotyczą wydzielania innych hormonów, takich jak adrenalina, noradrenalina, hormony przysadki czy hormony tarczycy. Egzocytoza pozwala na pulsacyjne, precyzyjnie regulowane uwalnianie cząsteczek sygnałowych. Dzięki temu organizm może dynamicznie reagować na stres, zmiany ciśnienia krwi, stanu gospodarki wodno-elektrolitowej czy rytmu dobowego.
Egzocytoza w układzie odpornościowym
Komórki układu odpornościowego również intensywnie wykorzystują egzocytozę. Limfocyty T cytotoksyczne i komórki NK wydzielają za pomocą pęcherzyków białka takie jak perforyna czy granzymy, które niszczą komórki zakażone wirusami lub nowotworowe. Proces ten jest niezwykle precyzyjny, ponieważ zniszczeniu mają ulec tylko wybrane cele, a nie całe otoczenie tkankowe.
Komórki prezentujące antygen, takie jak komórki dendrytyczne, wykorzystują egzocytozę do eksponowania kompleksów MHC z fragmentami obcych białek na swojej powierzchni. Umożliwia to rozpoznanie patogenów przez limfocyty i inicjację swoistej odpowiedzi immunologicznej. Zaburzenia tego procesu mogą prowadzić do niedoborów odporności, chorób autoimmunologicznych lub niewystarczającej odpowiedzi na zakażenia.
Egzocytoza a nowotworzenie i przerzuty
Komórki nowotworowe często zmieniają swój aparat egzocytotyczny. Intensywne wydzielanie enzymów proteolitycznych, czynników wzrostu i cząsteczek sygnałowych sprzyja degradacji macierzy zewnątrzkomórkowej, angiogenezie oraz migracji komórek rakowych. Egzocytoza odgrywa więc ważną rolę w procesie tworzenia przerzutów, umożliwiając komórkom nowotworowym opuszczenie guza pierwotnego i kolonizację odległych narządów.
W ostatnich latach szczególne zainteresowanie budzi egzocytoza pęcherzyków zewnątrzkomórkowych, takich jak egzosomy i mikropęcherzyki. Są one uwalniane przez wiele typów komórek, w tym nowotworowe, i przenoszą białka, lipidy oraz RNA, w tym miRNA, wpływając na zachowanie komórek docelowych. Egzosomy nowotworowe mogą modyfikować środowisko tkankowe tak, aby sprzyjało wzrostowi guza oraz ucieczce przed odpowiedzią immunologiczną.
Znaczenie egzocytozy w medycynie i biotechnologii
Zrozumienie mechanizmów egzocytozy otworzyło drogę do wielu zastosowań medycznych i biotechnologicznych. Modułowanie egzocytozy jest celem terapii w chorobach neurologicznych, takich jak padaczka czy choroba Parkinsona, gdzie leki wpływają na wydzielanie neuroprzekaźników. W diabetologii intensywnie bada się regulację egzocytozy insuliny, aby poprawić funkcjonowanie komórek β lub zastąpić je za pomocą komórek macierzystych zaprogramowanych do właściwego wydzielania.
W inżynierii biomedycznej próbuje się wykorzystywać pęcherzyki egzocytotyczne jako nośniki leków, na przykład egzosomy zaprojektowane tak, by dostarczać cząsteczki terapeutyczne do konkretnych tkanek. Dzięki naturalnym mechanizmom rozpoznawania i fuzji z błonami komórkowymi mogą one stanowić alternatywę dla syntetycznych nanopęcherzyków. Analiza składu egzosomów w płynach ustrojowych staje się również obiecującą metodą diagnostyki nowotworów i chorób neurodegeneracyjnych.
FAQ – najczęściej zadawane pytania o egzocytozę
Na czym polega podstawowa różnica między egzocytozą a endocytozą?
Egzocytoza i endocytoza to przeciwstawne kierunki transportu pęcherzykowego. W egzocytozie substancje są przenoszone z wnętrza komórki na zewnątrz za pośrednictwem pęcherzyków, które ulegają fuzji z błoną komórkową. W endocytozie następuje odwrotny proces: fragment błony wpukla się, obejmując cząsteczki z otoczenia, a następnie odcina, tworząc pęcherzyk endocytotyczny. Oba mechanizmy łącznie regulują wymianę materiału i powierzchni błony.
Dlaczego jony wapnia są tak ważne w egzocytozie?
Wiele form egzocytozy, zwłaszcza regulowana, jest bezpośrednio zależna od stężenia jonów Ca²⁺ w cytoplazmie. Po zadziałaniu bodźca, np. impulsu nerwowego, otwierają się kanały wapniowe w błonie, co prowadzi do szybkiego napływu jonów do komórki. Wzrost stężenia Ca²⁺ aktywuje białka czujnikowe, takie jak synaptotagmina, które przyspieszają ostatnią fazę fuzji pęcherzyka z błoną. Dzięki temu komórka może w ułamkach sekund uwolnić neuroprzekaźniki lub hormony.
Jakie choroby mogą wynikać z zaburzeń egzocytozy?
Nieprawidłowości w egzocytozie mogą prowadzić do szerokiego spektrum chorób. W układzie nerwowym zaburzone wydzielanie neuroprzekaźników wiąże się m.in. z padaczką, chorobą Parkinsona czy niektórymi postaciami depresji. W trzustce uszkodzenie mechanizmów egzocytozy insuliny sprzyja rozwojowi cukrzycy. W układzie odpornościowym defekty wydzielania cytotoksycznych granulek prowadzą do niedoborów odporności. Zmiany w aparacie egzocytotycznym towarzyszą też wielu nowotworom, ułatwiając ich inwazję.
Czy egzocytoza zachodzi tylko w komórkach zwierzęcych?
Egzocytoza występuje we wszystkich komórkach eukariotycznych, nie tylko zwierzęcych. Komórki roślinne wykorzystują ją m.in. do wydzielania składników ściany komórkowej, enzymów i substancji obronnych. U grzybów egzocytoza odpowiada za sekrecję enzymów trawiennych i toksyn. Różnica polega na tym, że u roślin i grzybów obecność sztywnej ściany komórkowej modyfikuje niektóre aspekty tego procesu, ale sama zasada pęcherzykowego transportu i fuzji błon jest zachowana.