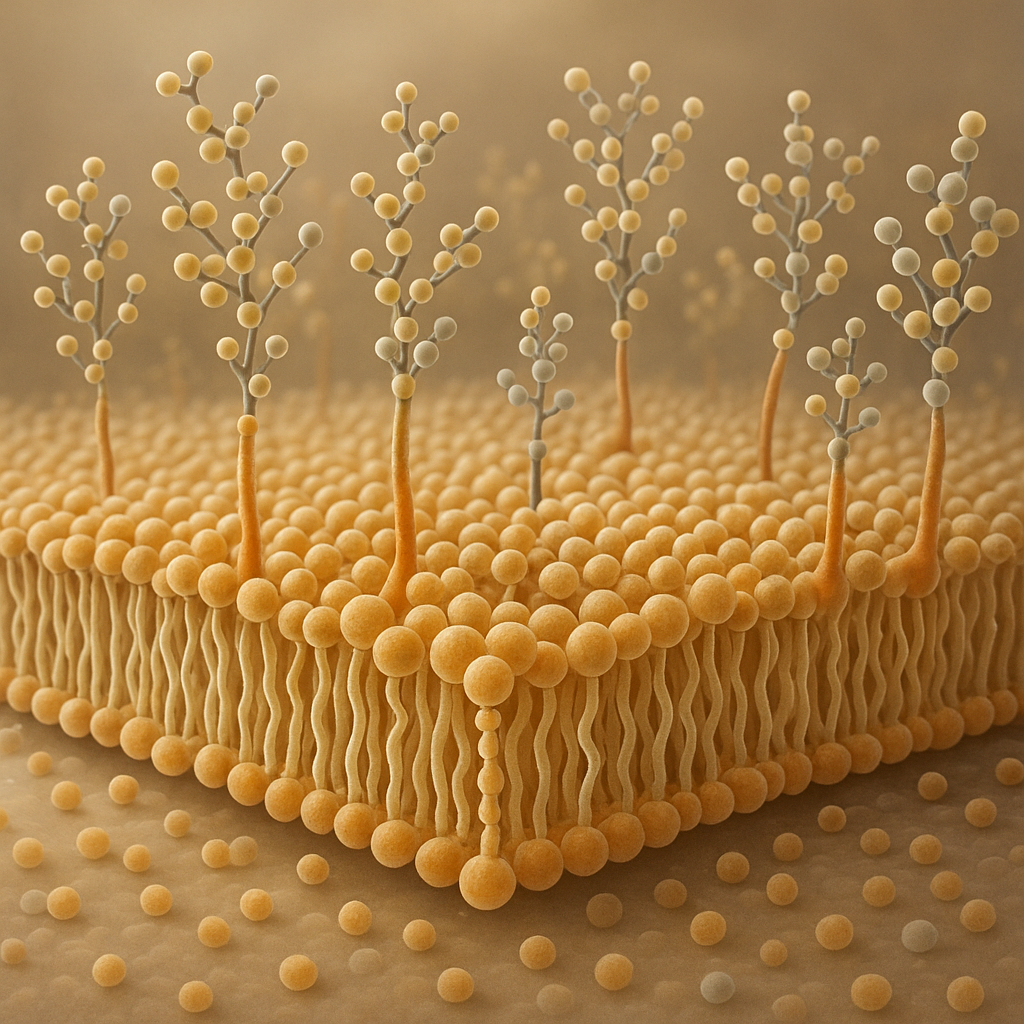
Glikokaliks to cienka, lecz niezwykle istotna warstwa węglowodanów i białek pokrywająca powierzchnię wielu komórek, przede wszystkim komórek zwierzęcych i niektórych bakterii. Choć niewidoczny gołym okiem, odgrywa kluczową rolę w komunikacji komórkowej, ochronie mechanicznej i chemicznej oraz w precyzyjnym rozpoznawaniu obcych struktur przez układ odpornościowy. Zrozumienie budowy i funkcji glikokaliksu pozwala lepiej pojąć, jak organizm zachowuje równowagę, broni się przed chorobami i reaguje na zmiany środowiska.
Budowa i skład chemiczny glikokaliksu
Termin glikokaliks (łac. glycocalyx) oznacza dosłownie „cukrową otoczkę”. Tworzy go gęsta sieć reszt cukrowych przyłączonych do lipidów i białek błonowych. Najważniejsze składniki strukturalne to:
- glikoproteiny – białka błonowe lub wydzielnicze, do których przyłączone są łańcuchy oligo- lub polisacharydowe (N- lub O-glikozylacja), często wystające daleko poza powierzchnię błony;
- glikolipidy – lipidy błonowe, zwykle sfingolipidy, z dołączonymi krótszymi łańcuchami cukrowymi, szczególnie liczne w zewnętrznej warstwie błony komórek nerwowych i nabłonkowych;
- proteoglikany – białka rdzeniowe połączone z długimi łańcuchami glikozaminoglikanów (GAG), takich jak heparan siarczan, chondroityna siarczan czy hialuronian.
Łańcuchy cukrowe zbudowane są z takich monosacharydów jak glukoza, galaktoza, N-acetyloglukozamina, N-acetylogalaktozamina, mannoza czy kwas sjalowy. Ich ułożenie jest nieprzypadkowe: specyficzna kombinacja cukrów oraz typ wiązania glikozydowego tworzą swoisty „kod węglowodanowy”. Ten kod jest odczytywany przez białka wiążące cukry, nazywane lektynami, zarówno własnymi, jak i pochodzącymi z mikroorganizmów.
Ważnym elementem glikokaliksu komórek zwierzęcych są także mukopolisacharydy, szczególnie silnie uwodnione i ujemnie naładowane, co nadaje powierzchni komórek właściwości lepko-elastyczne. W komórkach śródbłonka naczyniowego struktura ta określana jest jako „śródbłonkowy glikokaliks naczyniowy” i została bardzo dokładnie zbadana w kontekście chorób sercowo-naczyniowych.
Grubość glikokaliksu jest zróżnicowana – od kilkudziesięciu nanometrów do kilku mikrometrów. Zależy to od typu komórki, jej funkcji oraz warunków środowiskowych. Komórki nabłonka jelitowego, nerek czy naczyń krwionośnych posiadają szczególnie dobrze rozwinięty glikokaliks, co wiąże się z wysoką intensywnością wymiany substancji i koniecznością ochrony przed czynnikami uszkadzającymi.
Funkcje glikokaliksu w organizmach zwierzęcych
Ochrona mechaniczna i chemiczna komórek
Glikokaliks pełni funkcję pierwszej linii ochrony na styku komórka–środowisko zewnętrzne. Gęsta sieć węglowodanów tworzy barierę amortyzującą działanie sił ścinających w przepływającej krwi czy płynie tkankowym. Jest to szczególnie istotne w naczyniach krwionośnych, gdzie śródbłonek stale narażony jest na wpływ zmiennych ciśnień i przepływu.
Silne uwodnienie glikozaminoglikanów sprawia, że wokół komórki powstaje „hydratacyjny płaszcz”, który chroni przed odwodnieniem oraz nagłymi zmianami stężenia jonów i cząsteczek. Anionowe grupy siarczanowe i karboksylowe wiążą kationy, wpływając na lokalną równowagę elektrolitową i stabilizując środowisko mikrokomórkowe.
W środowisku jelita cienkiego glikokaliks tworzy warstwę ochronną dla mikrokosmków enterocytów, ograniczając bezpośredni kontakt z enzymami trawiennymi i bakteriami jelitowymi. Jednocześnie jednak umożliwia selektywną dyfuzję składników odżywczych oraz zapewnia miejsce zakotwiczenia dla enzymów błonowych, uczestniczących w końcowych etapach trawienia.
Rola w komunikacji komórkowej i rozpoznawaniu
Jedną z podstawowych ról glikokaliksu jest udział w komunikacji komórkowej. Łańcuchy cukrowe na powierzchni pełnią funkcję etykiet rozpoznawczych, decydujących o tym, jak komórka będzie postrzegana przez inne komórki organizmu, a także przez patogeny. W wielu przypadkach to właśnie konkretne struktury oligosacharydowe determinują przyłączanie się hormonów, cytokin czy cząsteczek adhezyjnych.
Przykładem są selektyny – białka znajdujące się na powierzchni komórek śródbłonka i leukocytów, które rozpoznają specyficzne motywy cukrowe. Dzięki temu leukocyty mogą przywierać do ściany naczynia i migrować do miejsc zapalenia. Gdyby kod węglowodanowy był zaburzony, precyzyjne kierowanie odpowiedzi immunologicznej stałoby się znacznie mniej skuteczne.
Glikokaliks odgrywa również zasadniczą rolę w rozpoznawaniu komórek własnych i obcych. Klasycznym przykładem jest antygenowa struktura układu grupowego krwi ABO, determinowana właśnie przez typ końcowych reszt cukrowych przyłączonych do glikolipidów i glikoprotein błonowych erytrocytów. Obecność lub brak określonych cukrów, takich jak N-acetylogalaktozamina czy galaktoza, decyduje o tym, do jakiej grupy krwi zaliczymy daną osobę, a tym samym o kompatybilności transfuzji.
Udział w odpowiedzi immunologicznej
Glikokaliks jest kluczowym elementem w funkcjonowaniu układu odpornościowego. Komórki immunologiczne rozpoznają wzorce cukrowe charakterystyczne dla patogenów, na przykład bogate w mannozę glikoproteiny grzybów czy specyficzne polisacharydy bakteryjne. Wzorce te określa się jako PAMP (pathogen-associated molecular patterns). Rozpoznanie PAMP odbywa się z udziałem receptorów PRR (pattern recognition receptors), w tym lektyn typu C.
Jednocześnie komórki gospodarza wystawiają na powierzchnię własne wzorce glikanowe, służące jako sygnały „self”. Zaburzenia w tym kodzie mogą prowadzić do nieprawidłowej aktywacji odpowiedzi immunologicznej, a nawet do rozwoju chorób autoimmunologicznych. Wiele nowotworów modyfikuje swój glikokaliks, eksponując odmienne struktury cukrowe, co pozwala im częściowo unikać wykrycia przez komórki odpornościowe.
Warto podkreślić, że liczne patogeny rozwinęły strategię „mimikry glikanowej”, czyli upodabniania swoich cukrów powierzchniowych do tych występujących u gospodarza. Umożliwia im to lepsze przyleganie do tkanek, a także utrudnia ich rozpoznanie. Przykładem są niektóre bakterie otoczkowe, których polisacharydowe otoczki przypominają struktury obecne w tkankach ssaków.
Regulacja przepuszczalności ścian naczyń krwionośnych
Śródbłonkowy glikokaliks naczyniowy tworzy złożoną, silnie uwodnioną warstwę pokrywającą światło naczyń. Jego obecność ma kluczowe znaczenie dla regulacji barierowych właściwości śródbłonka. Warstwa ta ogranicza bezpośredni kontakt elementów morfotycznych krwi z błoną komórkową, zmniejszając ryzyko adhezji trombocytów i tworzenia zakrzepów.
Glikozaminoglikany śródbłonkowego glikokaliksu wiążą albuminy oraz inne białka osocza, co sprzyja utrzymaniu gradientu onkotycznego i równowagi pomiędzy przesączaniem a resorpcją płynu w łożysku naczyniowym. Zniszczenie tej struktury, na przykład w przebiegu sepsy, cukrzycy czy stanu zapalnego, prowadzi do zwiększonej przepuszczalności naczyń, obrzęków i zaburzeń mikrokrążenia.
W ostatnich latach odkryto, że glikokaliks śródbłonkowy działa również jako mechanosensor – odbiera sygnały wynikające z sił ścinających generowanych przez przepływ krwi. Deformacja tej warstwy przekłada się na aktywację szlaków sygnalizacyjnych w komórkach śródbłonka, co wpływa na wytwarzanie tlenku azotu, regulację napięcia naczyń oraz procesy angiogenezy.
Glikokaliks w świecie mikroorganizmów i roślin
Glikokaliks bakterii: kapsuły i biofilmy
U bakterii glikokaliks przyjmuje często formę kapsuły lub luźniejszej warstwy śluzowej, zbudowanej z polisacharydów, czasem także z udziałem polipeptydów. Struktura ta pełni szereg istotnych funkcji ekologicznych i patogenetycznych. Kapsuła bakteryjna zwiększa odporność na wysychanie, chroni przed działaniem fagocytów i niektórych antybiotyków oraz ułatwia adhezję do powierzchni biologicznych i abiotycznych.
Tworzenie biofilmów jest jednym z najbardziej spektakularnych przykładów wykorzystania glikokaliksu. Bakterie otaczają się wspólną macierzą zewnątrzkomórkową, złożoną głównie z polisacharydów, białek i DNA, co tworzy złożoną, wielogatunkową społeczność. W takim układzie glikokaliks działa jak rusztowanie i tarcza ochronna, utrudniająca penetrację substancji antybakteryjnych i komórek układu odpornościowego.
Glikokaliks bakteryjny odgrywa też ważną rolę w kolonizacji jelita, jamy ustnej czy powierzchni skóry. W wielu przypadkach jest on czynnikiem zjadliwości – bez niego bakteria nie byłaby w stanie przetrwać w niesprzyjających warunkach gospodarza. Przykładem mogą być bakterie Streptococcus pneumoniae, których otoczka polisacharydowa jest głównym antygenem wykorzystywanym w szczepionkach.
Glikokaliks w komórkach roślinnych
Komórki roślinne posiadają sztywną ścianę komórkową zbudowaną głównie z celulozy, hemiceluloz i pektyn, która pełni wiele funkcji analogicznych do glikokaliksu. Na zewnętrznej powierzchni ściany komórkowej często występują dodatkowe warstwy polisacharydów, glikoprotein i glikolipidów, które można traktować jako funkcjonalny odpowiednik glikokaliksu.
Elementy te uczestniczą w adhezji komórek w tkankach, wymianie sygnałów pomiędzy komórkami oraz w odpowiedzi na czynniki patogenne. Wiele patogenów roślinnych, w tym grzyby i bakterie, rozpoznaje specyficzne struktury cukrowe powierzchni roślin, co ułatwia im przyczepianie się i infekcję. Z kolei roślina wykorzystuje modyfikacje swoich węglowodanów powierzchniowych do wzmacniania odporności i tworzenia barier, na przykład poprzez odkładanie kaluzy lub ligniny.
W strefach wzrostu korzeni, tzw. czapeczkach korzeniowych, występuje wydzielana na zewnątrz śluzowata substancja bogata w polisacharydy. Ułatwia ona penetrację gleby, wpływa na mikrobiom ryzosfery i stanowi istotny element komunikacji roślina–mikroorganizmy. W tym mikrośrodowisku interakcje węglowodan–białko decydują o tym, które mikroby zostaną przyciągnięte, a które odrzucone.
Porównanie glikokaliksu różnych organizmów
Mimo znacznych różnic w budowie i składzie, glikokaliks komórek zwierzęcych, bakterii i roślin pełni pewne wspólne, ewolucyjnie zachowane funkcje. Są to przede wszystkim:
- ochrona komórki przed czynnikami fizycznymi i chemicznymi;
- pośredniczenie w kontaktach z innymi komórkami i powierzchniami;
- udział w rozpoznawaniu „swój–obcy” oraz w odpowiedzi na patogeny;
- kształtowanie mikrośrodowiska wokół komórki poprzez wiązanie wody, jonów i białek.
Różnice wynikają natomiast głównie z rodzaju życia i warunków środowiskowych. U bakterii nacisk położony jest na odporność i tworzenie biofilmów, u zwierząt – na komunikację międzykomórkową i regulację przepuszczalności tkanek, zaś u roślin – na interakcje ze środowiskiem glebowym i patogenami. Ta różnorodność odzwierciedla ogromną plastyczność struktur węglowodanowych w świecie żywym.
Znaczenie glikokaliksu w medycynie i badaniach naukowych
Glikobiologia – nauka o cukrowych kodach
Rozwój metod analizy węglowodanów, takich jak spektrometria mas, wysokosprawna chromatografia czy nowoczesne techniki obrazowania, doprowadził do wyodrębnienia się glikobiologii – dziedziny badającej strukturę i funkcje glikanów. Okazało się, że sekwencje cukrowe są równie złożone i informacyjne jak sekwencje nukleotydów czy aminokwasów.
Glikokaliks jest jednym z głównych obiektów zainteresowania glikobiologii, ponieważ to właśnie tam koncentruje się ogromna różnorodność struktur cukrowych. Bada się m.in. zmiany glikozylacji w procesach nowotworzenia, różnice glikanowe pomiędzy komórkami zdrowymi a chorymi oraz wpływ modyfikacji cukrowych na działanie receptorów błonowych i kanałów jonowych.
Powstają nowe narzędzia, takie jak mikromacierze glikanowe, które pozwalają testować jednocześnie tysiące różnych struktur cukrowych i ich zdolność do wiązania białek. Umożliwia to identyfikację kluczowych motywów odpowiedzialnych za adhezję patogenów, odpowiedź immunologiczną czy przenoszenie sygnałów w komórce.
Rola glikokaliksu w chorobach układu krążenia
Śródbłonkowy glikokaliks naczyniowy znajduje się w centrum zainteresowania kardiologii i angiologii. Wykazano, że jego uszkodzenie jest jednym z wczesnych etapów rozwoju miażdżycy, nadciśnienia tętniczego oraz niewydolności serca. Czynniki takie jak hiperglikemia, stres oksydacyjny, stany zapalne czy długotrwałe podwyższenie ciśnienia tętniczego prowadzą do degradacji glikozaminoglikanów i przerzedzenia glikokaliksu.
Skutkuje to zwiększoną adhezją leukocytów i płytek krwi do ściany naczynia, większą przepuszczalnością dla lipoprotein i nasilonym rozwojem blaszki miażdżycowej. Białka i fragmenty glikozaminoglikanów uwalniane w wyniku degradacji glikokaliksu mogą być wykorzystywane jako biomarkery uszkodzenia śródbłonka, pomocne w ocenie ryzyka sercowo-naczyniowego.
Badane są również strategie terapeutyczne mające na celu ochronę lub odbudowę glikokaliksu. Należą do nich substancje wzmacniające syntezę glikozaminoglikanów, przeciwutleniacze, a także modyfikacje stylu życia ograniczające czynniki uszkadzające śródbłonek. Coraz lepiej rozumiana jest także rola aktywności fizycznej, która poprzez wpływ na siły ścinające może stymulować korzystne przebudowy glikokaliksu naczyń.
Glikokaliks a nowotwory
Komórki nowotworowe często charakteryzują się znaczącymi zmianami w strukturze glikokaliksu. Dochodzi do nadekspresji niektórych glikoprotein, pojawiania się tzw. nieprawidłowych antygenów nowotworowych oraz zwiększonej ilości kwasu sjalowego na powierzchni. Zmiany te wpływają na adhezję komórek, ich migrację oraz unikanie nadzoru immunologicznego.
Liczne nowotwory eksponują skrócone łańcuchy O-glikanów, takie jak antygeny T i Tn, rzadko występujące w komórkach prawidłowych. Są one rozpoznawane jako sygnały nowotworowe i stanowią potencjalne cele dla szczepionek przeciwnowotworowych oraz terapii opartych na przeciwciałach monoklonalnych. Wzmożona sialylacja glikoprotein może dodatkowo maskować epitopy rozpoznawane przez układ odpornościowy, utrudniając jego efektywne działanie.
Grubość i skład glikokaliksu komórek nowotworowych korelują niekiedy z agresywnością guza oraz zdolnością do tworzenia przerzutów. Gęstsza, bardziej zorganizowana warstwa glikanów może ułatwiać komórkom oderwanie się od guza pierwotnego, przeżycie w krążeniu i osiedlenie się w odległych narządach. Z tego powodu badanie glikokaliksu staje się ważnym elementem onkologicznej diagnostyki molekularnej.
Wykorzystanie glikokaliksu w projektowaniu terapii i leków
Zrozumienie kodu węglowodanowego glikokaliksu otwiera drogę do tworzenia bardziej precyzyjnych leków i systemów dostarczania substancji czynnych. Cząsteczki terapeutyczne można modyfikować tak, aby rozpoznawały specyficzne glikany na powierzchni wybranych komórek, na przykład komórek nowotworowych lub zakażonych wirusem. Dzięki temu możliwe jest zwiększenie selektywności terapii i ograniczenie działań niepożądanych.
Powstają także biomateriały, których powierzchnia pokryta jest określonymi glikanami, co wpływa na ich biokompatybilność i zdolność do integracji z tkankami. Projektuje się na przykład powłoki implantów czy stentów naczyniowych, które naśladują glikokaliks śródbłonka, redukując ryzyko zakrzepicy i reakcji zapalnej.
W dziedzinie szczepionek coraz większą uwagę zwraca się na antygeny polisacharydowe i glikokonjugaty. Łączenie polisacharydów bakteryjnych z białkami nośnikowymi zwiększa immunogenność szczepionek, czyniąc je skutecznymi także u niemowląt. Analiza glikokaliksu patogenów pozwala identyfikować struktury najbardziej konserwatywne i kluczowe dla zjadliwości, stanowiące obiecujące cele dla profilaktyki i terapii.
FAQ – najczęściej zadawane pytania o glikokaliks
Czym dokładnie jest glikokaliks i gdzie występuje?
Glikokaliks to zewnętrzna warstwa złożona z łańcuchów cukrowych przyłączonych do białek i lipidów błony komórkowej. Tworzy gęstą „otoczkę” na powierzchni wielu komórek, zwłaszcza zwierzęcych, śródbłonkowych, nabłonkowych oraz niektórych bakterii i komórek roślinnych. Jego grubość, skład i organizacja zależą od typu komórki oraz warunków środowiska, ale zawsze pełni funkcje ochronne i sygnalizacyjne.
Jakie są najważniejsze funkcje glikokaliksu w organizmie człowieka?
Glikokaliks chroni komórki przed uszkodzeniami mechanicznymi i chemicznymi, utrzymuje odpowiednie uwodnienie ich powierzchni i stabilizuje lokalne stężenie jonów. Uczestniczy w rozpoznawaniu komórek własnych i obcych, w adhezji leukocytów, w transporcie przez ścianę naczyń oraz w przekazywaniu sygnałów międzykomórkowych. W śródbłonku naczyń reguluje przepuszczalność, zapobiega zakrzepom i pośredniczy w reakcjach na zmiany przepływu krwi.
Dlaczego uszkodzenie glikokaliksu jest niebezpieczne?
Zniszczenie lub przerzedzenie glikokaliksu zwiększa kontakt komórek z czynnikami uszkadzającymi, nasila stan zapalny i sprzyja zaburzeniom mikrokrążenia. W naczyniach prowadzi do większej przepuszczalności ściany, obrzęków i łatwiejszego przylegania płytek krwi, co zwiększa ryzyko zakrzepów oraz rozwoju miażdżycy. Uszkodzony glikokaliks gorzej chroni też przed patogenami, a zmieniona struktura cukrowa może zaburzać prawidłową regulację układu odpornościowego.
W jaki sposób glikokaliks wiąże się z nowotworami?
Komórki nowotworowe często wykazują zmiany w składzie i organizacji glikokaliksu: nadmierną ilość niektórych glikoprotein, obecność nietypowych antygenów cukrowych oraz zwiększoną sialylację. Tak zmodyfikowany glikokaliks ułatwia im oderwanie się od guza, migrację i tworzenie przerzutów, a także częściowe unikanie odpowiedzi immunologicznej. Z drugiej strony te specyficzne struktury glikanowe stanowią potencjalne cele dla nowych metod diagnostyki i terapii ukierunkowanej na komórki nowotworowe.
Czy na glikokaliks można wpływać dietą lub stylem życia?
Nie ma jednego prostego składnika diety odbudowującego glikokaliks, ale styl życia ma znaczenie pośrednie. Czynniki uszkadzające, takie jak przewlekła hiperglikemia, palenie tytoniu, nadciśnienie, brak ruchu i dieta sprzyjająca stanowi zapalnemu, przyspieszają degradację glikokaliksu śródbłonka. Z kolei regularna aktywność fizyczna, kontrola glikemii, unikanie dymu tytoniowego i dieta bogata w antyoksydanty pomagają ograniczać stres oksydacyjny i wspierają naturalne mechanizmy jego regeneracji.