Nekroza jest jednym z kluczowych pojęć biologii i medycyny, opisującym nieodwracalną śmierć komórek w żywym organizmie. Zrozumienie jej mechanizmów ma ogromne znaczenie zarówno dla diagnostyki, jak i leczenia wielu chorób – od zawału serca, przez udar mózgu, po ciężkie zakażenia i urazy mechaniczne. Nekroza nie jest procesem przypadkowym; to złożona sekwencja zdarzeń biochemicznych i morfologicznych, której skutki mogą obejmować lokalne uszkodzenie tkanek, zaburzenia funkcji narządów, a nawet śmierć całego organizmu. W biologii komórki stanowi także kontrast wobec programowanej śmierci komórkowej, czyli apoptozy, co pozwala lepiej zrozumieć, jak organizm utrzymuje homeostazę i reaguje na skrajne stresy.
Definicja i podstawowe pojęcia związane z nekrozą
Nekroza to patologiczny proces prowadzący do trwałej utraty żywotności komórek, obejmujący ich niekontrolowany rozpad i uszkodzenie otaczających struktur. Jest przeciwieństwem fizjologicznej, ściśle regulowanej śmierci komórek, jaką jest apoptoza. W nekrozie dominują zjawiska związane z nagłym przerwaniem dopływu tlenu, energii lub składników odżywczych, a także działaniem czynników toksycznych i mechanicznych. W efekcie dochodzi do uszkodzenia błon komórkowych, zaburzeń jonowych, obrzęku i ostatecznie rozerwania komórki z uwolnieniem jej zawartości do przestrzeni międzykomórkowej.
Z biologicznego punktu widzenia nekroza nie dotyczy pojedynczej komórki w izolacji, lecz zwykle grup komórek w obrębie określonej tkanki lub narządu. Wokół ogniska martwicy rozwija się reakcja zapalna z udziałem leukocytów, mediatorów zapalnych i enzymów proteolitycznych. Nekroza może mieć charakter ograniczony, gdy obejmuje niewielki fragment tkanki, lub rozległy, prowadząc do istotnego upośledzenia funkcji całego narządu, na przykład mięśnia sercowego czy kory mózgu.
W praktyce klinicznej pojęcie nekrozy pojawia się m.in. w kontekście zawałów, zgorzeli, martwicy rozpływnej w trzustce, a także w przebiegu ciężkich infekcji bakteryjnych. W biologii eksperymentalnej nekroza jest z kolei analizowana jako końcowy efekt nadmiernego stresu oksydacyjnego, uszkodzeń DNA czy toksycznego działania ksenobiotyków. Współczesne badania coraz częściej podkreślają, że niektóre formy nekrozy mogą mieć element regulowany, jak w przypadku nekroptozy, co częściowo zaciera granicę między śmiercią przypadkową a programowaną.
Mechanizmy komórkowe i morfologiczne cechy nekrozy
Utrata homeostazy i rola błony komórkowej
Kluczowym elementem nekrozy jest utrata zdolności komórki do utrzymania homeostazy. Błona komórkowa przestaje pełnić funkcję bariery, a pompy jonowe zależne od ATP ulegają zahamowaniu wskutek niedoboru energii. Najczęściej dzieje się tak w wyniku niedotlenienia, zatrzymania przepływu krwi lub toksycznego uszkodzenia mitochondriów, które są głównym źródłem energii w komórce. Utrata ATP prowadzi do zaburzeń gradientów jonowych, szczególnie jonów sodu i wapnia, co wywołuje napływ wody do komórki i jej obrzęk.
Narastający obrzęk obejmuje również organella wewnątrzkomórkowe, w tym mitochondria i siateczkę śródplazmatyczną. Dochodzi do odszczepiania rybosomów od siateczki szorstkiej, co zaburza syntezę białek. Struktura błon komórkowych ulega destabilizacji, zwiększa się ich przepuszczalność, a w skrajnych warunkach błona pęka. Uwolnione do przestrzeni zewnątrzkomórkowej enzymy lizosomalne i inne składniki cytoplazmy nasilają uszkodzenie sąsiednich komórek oraz inicjują intensywną odpowiedź zapalną.
Stres oksydacyjny i uszkodzenia biocząsteczek
Istotną rolę w przebiegu nekrozy odgrywa stres oksydacyjny. Nadmierna produkcja reaktywnych form tlenu (ROS) w warunkach niedokrwienia i reperfuzji, działania toksyn czy promieniowania prowadzi do uszkodzeń lipidów, białek i kwasów nukleinowych. Peroksydacja lipidów błon komórkowych powoduje ich „rozszczelnienie”, zaburzenia sygnalizacji i większą podatność na mechaniczne przerwanie. Modyfikacje białek enzymatycznych mogą wyłączać kluczowe szlaki metaboliczne, a uszkodzenia DNA przekraczają możliwości systemów naprawczych.
ROS powstają głównie w mitochondriach oraz w błonach komórkowych, gdzie aktywne są oksydazy NADPH. W warunkach fizjologicznych istnieją liczne antyoksydanty, takie jak glutation, katalaza czy dysmutaza ponadtlenkowa, które neutralizują nadmiar wolnych rodników. W nekrozie dochodzi do ich wyczerpania lub przeciążenia, co prowadzi do samonapędzającej się spirali uszkodzeń. Proces ten jest szczególnie wyraźny w tkankach o dużym zapotrzebowaniu na tlen, jak mięsień sercowy czy neurony ośrodkowego układu nerwowego.
Morfologiczne obrazy nekrozy w mikroskopii
Pod mikroskopem świetlnym komórki nekrotyczne wykazują charakterystyczne zmiany jądra i cytoplazmy. Do najbardziej typowych należą: pyknosis (obkurczenie jądra), karyorrhexis (fragmentacja jądra) oraz karyolysis (rozpuszczenie jądra). Cytoplazma staje się intensywniej kwasochłonna, co wynika z denaturacji białek i utraty RNA. Komórki tracą typowy kształt, zanikają struktury wewnątrzkomórkowe, a granice komórek stają się niewyraźne.
W otoczeniu ogniska martwiczego widoczny jest odczyn zapalny, obejmujący naciek neutrofili, makrofagów i limfocytów. Komórki te pomagają w usuwaniu martwej tkanki poprzez fagocytozę i wydzielanie enzymów proteolitycznych. W miarę upływu czasu martwicze obszary mogą ulec upłynnieniu, rozpuszczeniu lub otorbieniu przez tkankę łączną, prowadząc do powstania blizny, jamy lub zwapnienia. Obraz mikroskopowy nekrozy jest ważnym narzędziem diagnostycznym w histopatologii, pozwalającym na różnicowanie typów uszkodzeń i chorób.
Rodzaje nekrozy i ich znaczenie biologiczne
Nekroza skrzepowa i rozplywna
Jednym z podstawowych podziałów nekrozy jest rozróżnienie na typ skrzepowy i rozpływny. Nekroza skrzepowa występuje najczęściej w narządach o zwartej budowie, takich jak serce, nerki czy śledziona, i jest typowa dla niedokrwienia. W jej przebiegu dochodzi do denaturacji białek strukturalnych i enzymatycznych, co hamuje autolizę komórek. W efekcie zarys tkanek i komórek pozostaje przez pewien czas zachowany, choć są one martwe. Przykładem klinicznym jest ognisko zawału mięśnia sercowego, gdzie w obrazie histologicznym widać „cienie” włókien mięśniowych bez jąder.
Nekroza rozpływna charakteryzuje się z kolei przewagą procesów trawienia enzymatycznego nad denaturacją białek. W jej przebiegu tkanka ulega upłynnieniu, tworząc gęstą, półpłynną masę. Typowa jest dla ośrodkowego układu nerwowego, gdzie uszkodzone obszary mózgu zamieniają się z czasem w jamy wypełnione płynem. Nekroza rozpływna występuje również w ropniach, gdzie masy martwicze są intensywnie trawione przez enzymy neutrofili i bakterii, prowadząc do powstania ropnej treści.
Zgorzel, martwica tłuszczowa i serowata
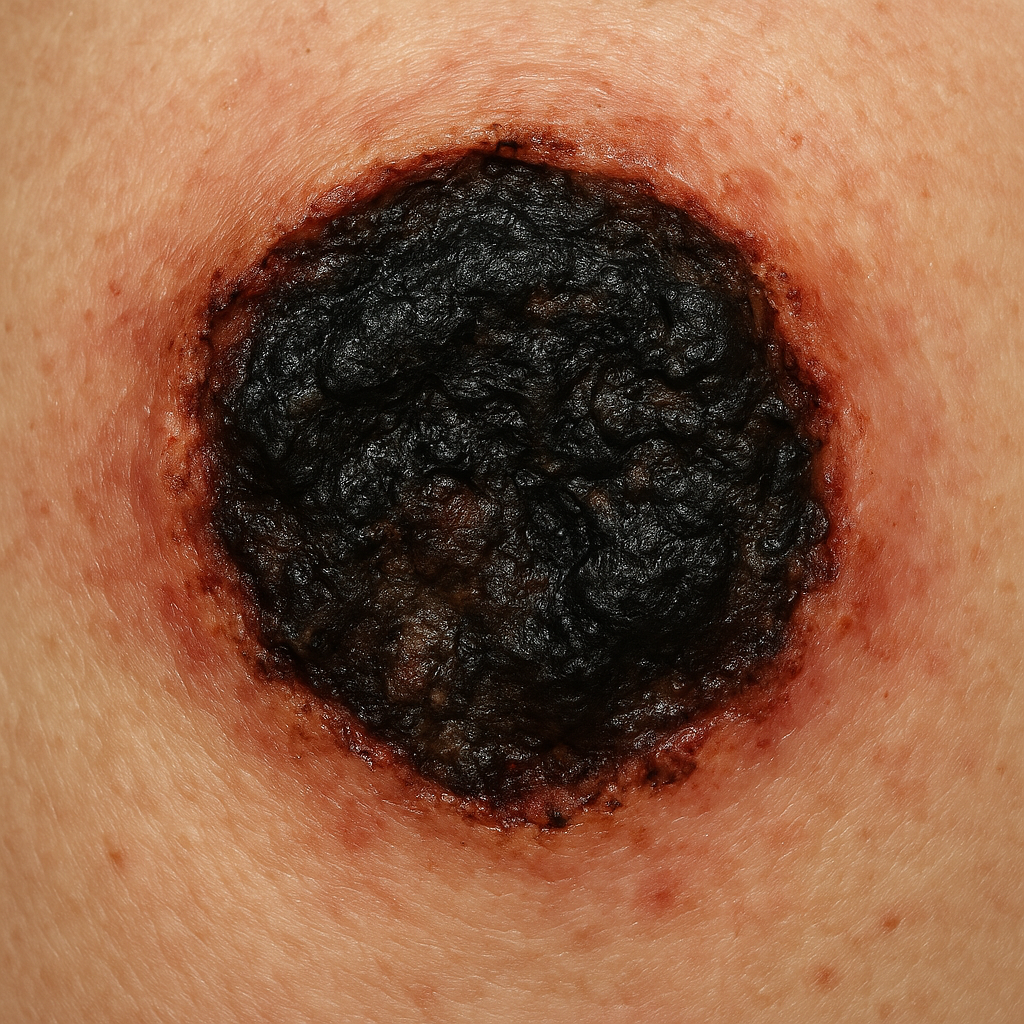
Specyficzną formą martwicy jest zgorzel, czyli nekroza tkanek narażonych na kontakt ze środowiskiem zewnętrznym lub zakażenie bakteryjne. Zgorzel sucha rozwija się najczęściej w wyniku niedokrwienia kończyn, na przykład przy zaawansowanej miażdżycy, i objawia się wysychaniem oraz czernieniem tkanek. Zgorzel wilgotna występuje, gdy do niedokrwionej tkanki dołącza się infekcja bakteryjna, prowadząc do gnicia, nieprzyjemnego zapachu i szybkiego szerzenia się zmian. Szczególnie niebezpieczna jest zgorzel gazowa, związana z zakażeniem bakteriami beztlenowymi, które produkują gazy i toksyny, powodując masywne zniszczenie tkanek.
Martwica tłuszczowa występuje głównie w tkance tłuszczowej i trzustce. W trzustce enzymy trawienne, zwłaszcza lipazy, uwalniane na skutek uszkodzenia komórek acynalnych rozkładają triacyloglicerole na glicerol i wolne kwasy tłuszczowe. Te z kolei łączą się z jonami wapnia, tworząc kredowobiałe mydła wapniowe – proces ten nazywa się zmydleniem tłuszczów. Morfologicznie widoczne są nieregularne, białe ogniska w tkance tłuszczowej. Martwica serowata jest charakterystyczna m.in. dla gruźlicy; tkanka przybiera konsystencję przypominającą biały ser i w obrazie mikroskopowym widać bezpostaciową, ziarnistą masę komórkową otoczoną ziarniniakiem.
Nekroptoza i inne formy śmierci nekrotycznej
W ostatnich latach coraz częściej opisuje się formy śmierci komórkowej, które łączą cechy nekrozy i apoptozy. Najlepiej poznaną z nich jest nekroptoza, proces regulowany przez specyficzne kinazy białkowe (RIPK1, RIPK3) i pseudokinazę MLKL. Aktywacja szlaku nekroptozy prowadzi do uszkodzenia błony komórkowej i uwolnienia zawartości komórki, podobnie jak w klasycznej nekrozie, ale przebieg jest zależny od kontrolowanych sygnałów wewnątrzkomórkowych. Nekroptoza może być uruchamiana m.in. przez receptory TNF, wzorce rozpoznawane przez receptory TLR oraz w odpowiedzi na zakażenia wirusowe.
Inne formy śmierci nekrotycznej to pyroptoza i ferroptoza. Pyroptoza zachodzi głównie w komórkach układu odpornościowego i jest związana z aktywacją inflamasomu oraz kaspazy-1, prowadząc do wytworzenia porów w błonie i szybkiej lizy komórki. Proces ten ma znaczenie w odpowiedzi na zakażenia bakteryjne i wirusowe, ale może też prowadzić do uszkodzeń tkanek w chorobach zapalnych. Ferroptoza to natomiast zależna od żelaza forma śmierci, w której kluczowa jest peroksydacja lipidów błon komórkowych; wiąże się ją z uszkodzeniami neuronów i komórek nowotworowych, co czyni ją obiecującym celem terapeutycznym.
Przyczyny nekrozy i jej konsekwencje dla organizmu
Niedokrwienie, toksyny, infekcje
Do najczęstszych przyczyn nekrozy należy niedokrwienie, czyli przerwanie lub znaczne ograniczenie dopływu krwi do tkanek. Brak tlenu i substratów energetycznych prowadzi do gwałtownego spadku produkcji ATP, dysfunkcji pomp jonowych i akumulacji metabolitów beztlenowych, takich jak kwas mlekowy. Zjawiska te powodują kwasicę wewnątrzkomórkową, obrzęk i ostatecznie śmierć komórki. Typowe przykłady to zawał mięśnia sercowego, zawał jelita czy martwica kory nerki. Szybkie przywrócenie przepływu krwi może ograniczyć rozległość martwicy, choć paradoksalnie reperfuzja wywołuje dodatkowy stres oksydacyjny.
Drugą ważną grupą czynników wywołujących nekrozę są toksyny chemiczne i biologiczne. Substancje takie jak metale ciężkie, rozpuszczalniki organiczne, niektóre leki w dużych dawkach czy jad węży mogą bezpośrednio uszkadzać błony, mitochondria lub DNA. Toksyny bakteryjne, na przykład produkowane przez Clostridium perfringens, niszczą ściany naczyń i struktury komórkowe, indukując gwałtowną martwicę. Również promieniowanie jonizujące, nadmiar promieni UV oraz skrajne temperatury (oparzenia, odmrożenia) prowadzą do nieodwracalnych uszkodzeń białek i kwasów nukleinowych, kończąc się nekrozą tkanek.
Reakcja zapalna i przebudowa tkanek
Nekroza uruchamia silną odpowiedź zapalną. Uwolnione fragmenty komórek, nazywane DAMPs (damage-associated molecular patterns), są rozpoznawane przez receptory układu immunologicznego, co prowadzi do wydzielania cytokin prozapalnych, takich jak TNF-α, IL-1β czy IL-6. Neutrofile i makrofagi migrują do miejsca uszkodzenia, fagocytują resztki martwych komórek i wydzielają enzymy proteolityczne. Proces ten pomaga oczyścić ognisko martwicze, ale jednocześnie może prowadzić do dodatkowego uszkodzenia żywych tkanek, jeśli stan zapalny jest nadmierny lub długotrwały.
W dalszej fazie rola układu odpornościowego i komórek zrębu tkanek ulega zmianie: zaczyna dominować naprawa i przebudowa. Fibroblasty produkują kolagen i inne składniki macierzy pozakomórkowej, naczynia krwionośne ulegają reorganizacji, a ubytki tkanek są wypełniane tkanką łączną włóknistą. Prowadzi to do powstania blizny, która przywraca ciągłość strukturalną, ale zwykle wiąże się z utratą właściwej funkcji danego obszaru. W niektórych narządach, jak wątroba, istnieje stosunkowo duży potencjał regeneracyjny, natomiast w mózgu czy mięśniu sercowym martwica pozostawia nieodwracalne ubytki funkcjonalne.
Nekroza w chorobach przewlekłych i nowotworach
Nekroza nie jest wyłącznie zjawiskiem nagłym; może również występować w przebiegu chorób przewlekłych. W miażdżycy dochodzi do powstawania ognisk martwicy w obrębie blaszek miażdżycowych, co sprzyja ich niestabilności i pękaniu, a w konsekwencji zawałom i udarom. W przewlekłych zapaleniach, takich jak reumatoidalne zapalenie stawów czy przewlekłe choroby wątroby, utrzymująca się martwica tkanek i odpowiedź zapalna prowadzą do postępującego włóknienia i utraty funkcji narządu. Martwica kości (martwica jałowa) może rozwijać się w wyniku zaburzeń ukrwienia, urazów lub długotrwałego stosowania niektórych leków, np. glikokortykosteroidów.
W guzach nowotworowych nekroza ma szczególne znaczenie. Rozrastający się nowotwór często przekracza zdolności swojej sieci naczyniowej do zaopatrzenia w tlen i składniki odżywcze, co prowadzi do martwicy w centralnych częściach guza. Obecność martwicy w obrazie histopatologicznym jest często wskaźnikiem agresywności nowotworu. Uwolnione z martwiczych komórek substancje mogą dodatkowo pobudzać stan zapalny i angiogenezę, tworząc środowisko sprzyjające dalszemu wzrostowi guza i jego niestabilności genetycznej. Tym samym nekroza staje się jednym z elementów złożonej interakcji między nowotworem a gospodarzem.
Znaczenie nekrozy w diagnostyce, terapii i badaniach naukowych
Rola nekrozy w diagnostyce klinicznej
Obecność nekrozy jest ważnym kryterium diagnostycznym w wielu dziedzinach medycyny. W kardiologii markery uszkodzenia kardiomiocytów, takie jak troponiny czy kinaza kreatynowa, wzrastają we krwi w wyniku martwicy mięśnia sercowego. Pozwala to rozpoznać zawał i ocenić jego rozległość. W neurologii badania obrazowe, szczególnie rezonans magnetyczny, uwidaczniają obszary martwicy mózgu po udarze, co ma kluczowe znaczenie dla planowania rehabilitacji i oceny rokowania. W nefrologii rozległa martwica kory nerek może prowadzić do ostrej niewydolności nerek, wymagającej dializoterapii.
Histopatologiczne rozpoznanie typu nekrozy pomaga różnicować choroby o podobnym obrazie klinicznym. Na przykład martwica serowata wskazuje na proces ziarniniakowy, często gruźliczy, podczas gdy rozległa martwica rozpływna z naciekiem neutrofili sugeruje ropień bakteryjny. W patomorfologii nowotworów stopień i charakter martwicy mogą wpływać na klasyfikację guza, ocenę jego złośliwości i decyzje terapeutyczne. Nekrotyczne fragmenty tkanek pobrane podczas biopsji są także analizowane pod kątem obecności patogenów, toksyn lub złogów, co ułatwia ustalenie etiologii choroby.
Terapie ukierunkowane na ograniczenie nekrozy
W praktyce klinicznej jednym z głównych celów terapeutycznych jest ograniczenie rozległości martwicy i wtórnych uszkodzeń. W ostrym zawale serca priorytetem jest jak najszybsze przywrócenie przepływu krwi w tętnicy wieńcowej, co zmniejsza obszar nieodwracalnego uszkodzenia mięśnia. Leki trombolityczne, angioplastyka wieńcowa i stenty są narzędziami, które umożliwiają szybkie udrożnienie naczynia. Podobne zasady stosuje się w leczeniu udaru niedokrwiennego mózgu, gdzie okno czasowe na efektywną interwencję jest jednak bardzo wąskie.
Równolegle rozwijane są strategie farmakologiczne mające na celu modulowanie stresu oksydacyjnego, hamowanie napływu jonów wapnia czy stabilizację błon komórkowych. Antyoksydanty, blokery kanałów wapniowych i niektóre leki przeciwzapalne mogą zmniejszać uszkodzenia reperfuzyjne i ograniczać rozwój martwicy. W dziedzinie transplantologii duże znaczenie ma ochrona narządów przed nekrozą podczas pobierania, przechowywania i przeszczepiania, co osiąga się przez stosowanie odpowiednich płynów konserwujących, chłodzenia i kontroli czasu niedokrwienia.
Nekroza jako obiekt badań naukowych
Badania nad nekrozą mają fundamentalne znaczenie dla zrozumienia patofizjologii wielu chorób i opracowania nowych terapii. Analizowane są szlaki sygnałowe prowadzące do różnych form śmierci komórkowej, interakcje między komórkami umierającymi a układem odpornościowym, a także wpływ mikrośrodowiska tkankowego na przebieg martwicy. W modelach zwierzęcych i komórkowych bada się, jak modulacja określonych białek, np. kinaz związanych z nekroptozą, może chronić tkanki przed uszkodzeniem lub przeciwnie – nasilać śmierć komórek nowotworowych.
Współczesne techniki obrazowania, takie jak mikroskopia konfokalna, tomografia emisyjna czy obrazowanie in vivo z użyciem barwników fluorescencyjnych, pozwalają śledzić nekrozę w czasie rzeczywistym. Umożliwia to obserwację dynamiki zmian w pojedynczych komórkach oraz całych narządach. Coraz częściej wykorzystuje się także narzędzia bioinformatyczne do analizy dużych zbiorów danych genetycznych i proteomicznych związanych z odpowiedzią komórek na stres nekrotyczny. Dzięki temu można identyfikować nowe cele molekularne dla leków i lepiej przewidywać odpowiedź organizmu na uszkodzenia.
FAQ – najczęstsze pytania dotyczące nekrozy
Na czym polega podstawowa różnica między nekrozą a apoptozą?
Nekroza to niekontrolowana, zwykle patologiczna śmierć komórek związana z uszkodzeniem błon, obrzękiem i pęknięciem komórki, czemu towarzyszy silny stan zapalny. Apoptoza natomiast jest procesem programowanej śmierci komórkowej, ściśle regulowanym przez szlaki sygnałowe. Komórka ulega skurczeniu, jej DNA jest precyzyjnie fragmentowane, a resztki są szybko usuwane przez fagocyty bez istotnego wywoływania reakcji zapalnej.
Czy nekroza może się cofnąć, jeśli przywróci się dopływ krwi do tkanki?
Gdy komórki osiągną stadium pełnoobjawowej nekrozy, proces jest już nieodwracalny – struktury komórkowe uległy zniszczeniu, a błona została trwale uszkodzona. Szybkie przywrócenie przepływu krwi może jednak uratować komórki znajdujące się w strefie przejściowej między odwracalnym a nieodwracalnym uszkodzeniem. W praktyce klinicznej liczy się czas: im wcześniej przeprowadzona jest interwencja, tym mniejszy obszar martwicy i lepsze rokowanie pacjenta.
Jakie objawy kliniczne mogą sugerować obecność nekrozy w organizmie?
Objawy zależą od lokalizacji. Nekroza mięśnia sercowego objawia się bólem w klatce piersiowej, dusznością, zaburzeniami rytmu serca i wzrostem troponin. Martwica kończyny może powodować ból, zasinienie, utratę czucia, a w zgorzeli – czernienie i nieprzyjemny zapach. Udar mózgu z martwicą tkanki nerwowej prowadzi do nagłego niedowładu, zaburzeń mowy lub świadomości. Często towarzyszą temu objawy ogólne, takie jak gorączka, osłabienie i przyspieszona akcja serca.
Czy organizm może w pełni zregenerować tkankę po nekrozie?
Możliwość regeneracji zależy od rodzaju tkanki i rozległości uszkodzenia. Narządy o dużym potencjale odnowy, jak wątroba czy nabłonki, mogą częściowo odtworzyć utracone struktury, jeśli rusztowanie tkankowe (macierz pozakomórkowa) pozostanie zachowane. W wielu tkankach wysoko wyspecjalizowanych, jak mięsień sercowy czy neurony mózgu, martwica prowadzi do trwałej utraty komórek, a ubytki są zastępowane tkanką łączną włóknistą, czyli blizną, co obniża funkcję narządu.
Czy nekroza zawsze wiąże się z zakażeniem bakteryjnym?
Nekroza nie musi być związana z zakażeniem. Często powstaje wyłącznie z powodu niedokrwienia, działania toksyn chemicznych czy urazu mechanicznego. Infekcje bakteryjne mogą jednak nasilać martwicę lub być jej pierwotną przyczyną, jak w zgorzeli gazowej czy niektórych ropniach. W martwiczych tkankach łatwo rozwijają się drobnoustroje, bo ukrwienie jest słabe, a mechanizmy obronne gospodarza – upośledzone. Dlatego w wielu przypadkach konieczne jest jednoczesne leczenie przyczynowe i przeciwbakteryjne.