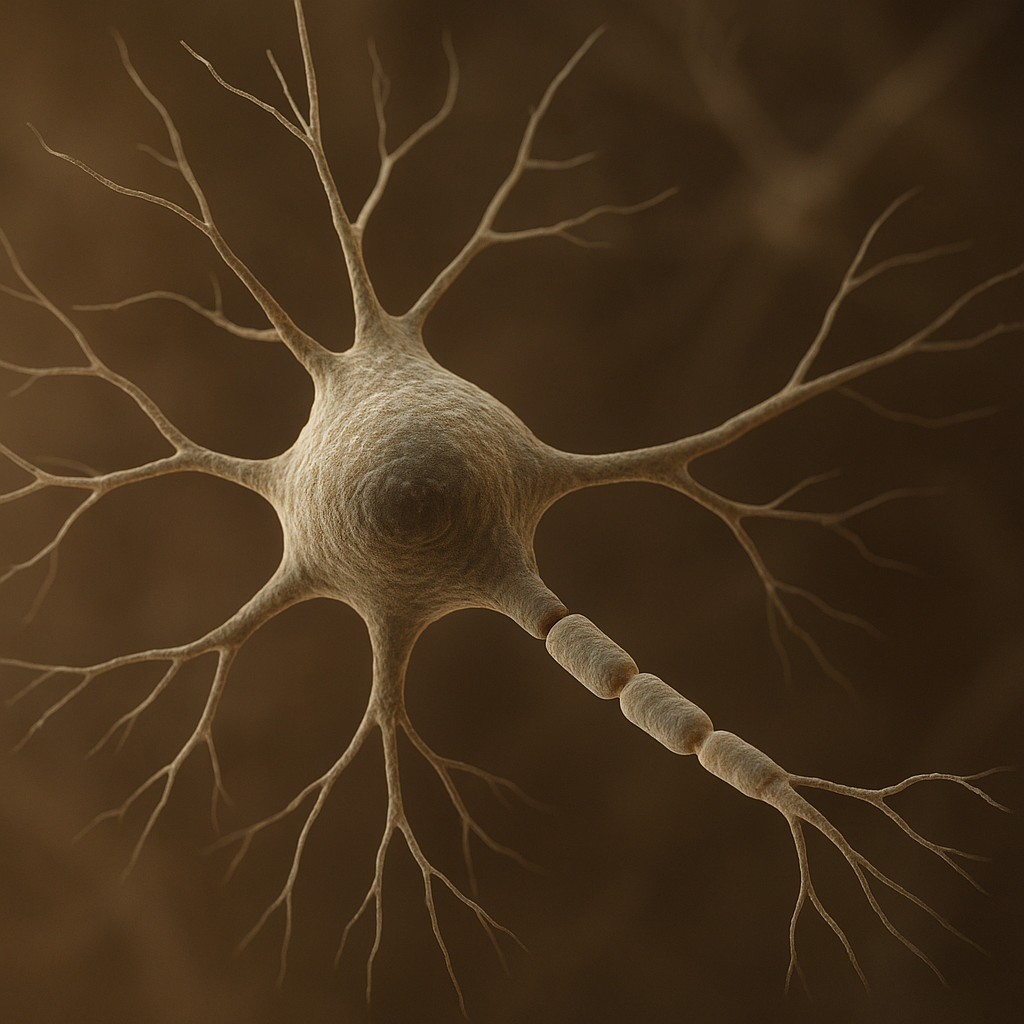
Neuron jest podstawową jednostką funkcjonalną układu nerwowego, komórką wyspecjalizowaną w odbieraniu, przetwarzaniu i przekazywaniu informacji w postaci impulsów elektrycznych i sygnałów chemicznych. Zrozumienie budowy, działania i różnorodności neuronów stanowi fundament nowoczesnej biologii, medycyny i nauk kognitywnych, a także leży u podstaw rozwoju sztucznej inteligencji i badań nad świadomością.
Budowa neuronu i jego właściwości elektryczne
Typowy neuron składa się z trzech głównych części: ciała komórkowego (soma), dendrytów oraz aksonu. Ciało komórkowe zawiera jądro komórkowe z materiałem genetycznym oraz większość organelli odpowiedzialnych za metabolizm, syntezę białek i utrzymanie homeostazy komórki. Dendryty są zwykle krótkimi, rozgałęzionymi wypustkami, które odbierają bodźce od innych neuronów lub receptorów czuciowych. Akson, często pojedynczy i znacznie dłuższy, przewodzi pobudzenie z ciała komórkowego w kierunku zakończeń nerwowych.
Kluczową cechą neuronu jest jego zdolność do generowania i przewodzenia impulsu nerwowego, zwanego potencjałem czynnościowym. Potencjał ten powstaje w wyniku szybkich zmian przepuszczalności błony komórkowej dla jonów sodu (Na+) i potasu (K+). Różnica stężeń tych jonów po obu stronach błony jest utrzymywana dzięki działaniu pompy sodowo-potasowej, która z wykorzystaniem energii ATP usuwa Na+ na zewnątrz komórki i transportuje K+ do jej wnętrza. W spoczynku neuron ma potencjał błonowy rzędu około –70 mV, co określa się jako potencjał spoczynkowy.
Gdy neuron zostanie dostatecznie pobudzony, np. przez bodziec chemiczny na synapsie lub bodziec mechaniczny w receptorze czuciowym, dochodzi do depolaryzacji błony. Jeśli osiągnięty zostanie próg pobudliwości, w błonie aksonu otwierają się napięciozależne kanały sodowe, co prowadzi do gwałtownego napływu Na+ i odwrócenia ładunku elektrycznego po wewnętrznej stronie błony. Jest to początek potencjału czynnościowego. Następnie otwierają się kanały potasowe, umożliwiając wypływ K+ na zewnątrz, co przywraca ujemny potencjał po stronie wewnętrznej – etap ten nazywamy repolaryzacją.
Przewodzenie impulsu wzdłuż aksonu może odbywać się na dwa główne sposoby: ciągły oraz skokowy. W aksonach niezmielinizowanych depolaryzacja przesuwa się krok po kroku wzdłuż całej błony aksonu, co jest procesem stosunkowo wolnym. W aksonach pokrytych osłonką mielinową impuls „przeskakuje” pomiędzy przewężeniami Ranviera, gdzie błona neuronu pozostaje odsłonięta. Takie skokowe przewodzenie znacznie zwiększa prędkość transmisji i zmniejsza zużycie energii, ponieważ wymaga mniej intensywnej pracy pomp jonowych do przywrócenia potencjału spoczynkowego.
Za wytworzenie osłonki mielinowej odpowiadają wyspecjalizowane komórki glejowe. W obwodowym układzie nerwowym są to komórki Schwanna, natomiast w ośrodkowym układzie nerwowym rolę tę pełnią oligodendrocyty. Mielina pełni funkcję izolatora elektrycznego, podobnie jak izolacja na przewodach elektrycznych, i znacząco poprawia efektywność przewodzenia sygnałów w układzie nerwowym kręgowców, w tym człowieka.
Ważną właściwością neuronu jest także okres refrakcji, czyli czas po wygenerowaniu potencjału czynnościowego, w którym neuronu nie można pobudzić ponownie lub jego pobudliwość jest ograniczona. Okres ten, wynikający z czasowej inaktywacji kanałów sodowych, zapewnia jednokierunkowe przewodzenie impulsu – od ciała komórkowego w kierunku zakończeń aksonu – oraz zapobiega nakładaniu się zbyt gęsto rozmieszczonych potencjałów czynnościowych.
Synapsy, neuroprzekaźniki i plastyczność
Neuron nie działa w izolacji; jest elementem rozległej sieci komórkowej, w której komunikacja odbywa się głównie za pośrednictwem synaps. Synapsa to wyspecjalizowane połączenie między zakończeniem aksonu jednego neuronu a dendrytem, somą lub aksonem innego neuronu, a także między neuronem a komórką efektorową, np. komórką mięśniową. Wyróżniamy synapsy elektryczne i chemiczne, przy czym w układzie nerwowym ssaków dominują synapsy chemiczne.
W synapsie chemicznej zakończenie aksonu, zwane kolbką synaptyczną, zawiera pęcherzyki wypełnione związkami chemicznymi – neuroprzekaźnikami. Gdy potencjał czynnościowy dociera do zakończenia nerwowego, otwierają się kanały wapniowe i do wnętrza kolbki napływają jony Ca2+. To właśnie wzrost stężenia wapnia inicjuje fuzję pęcherzyków synaptycznych z błoną presynaptyczną i uwolnienie neuroprzekaźnika do szczeliny synaptycznej.
Po uwolnieniu do szczeliny synaptycznej cząsteczki neuroprzekaźnika dyfundują w kierunku błony postsynaptycznej, gdzie wiążą się z odpowiednimi receptorami białkowymi. Aktywacja tych receptorów może prowadzić do otwarcia kanałów jonowych i zmiany potencjału błonowego komórki postsynaptycznej. Jeśli zmiana ta sprzyja depolaryzacji i zbliża potencjał do progu pobudliwości, mówimy o potencjale pobudzającym (EPSP). Jeśli natomiast dochodzi do hiperpolaryzacji i zmniejszenia szansy wygenerowania impulsu, mamy do czynienia z potencjałem hamującym (IPSP).
Do najważniejszych neuroprzekaźników należy glutaminian, główny neuroprzekaźnik pobudzający w ośrodkowym układzie nerwowym ssaków. Jest on kluczowy dla procesów uczenia się i pamięci, ponieważ aktywuje receptory, takie jak NMDA i AMPA, biorące udział w zjawisku długotrwałego wzmocnienia synaptycznego (LTP). Z kolei GABA (kwas gamma-aminomasłowy) jest głównym neuroprzekaźnikiem hamującym, odpowiedzialnym za utrzymanie równowagi pomiędzy pobudzeniem a hamowaniem w sieciach neuronalnych. Inne istotne substancje to acetylocholina, dopamina, serotonina czy noradrenalina, pełniące złożone funkcje w regulacji ruchu, nastroju, uwagi i motywacji.
Po spełnieniu swojej funkcji neuroprzekaźnik musi zostać usunięty ze szczeliny synaptycznej, aby umożliwić kolejne, precyzyjnie kontrolowane akty zdarzeń synaptycznych. Dzieje się to poprzez wychwyt zwrotny do zakończenia presynaptycznego, rozkład enzymatyczny lub dyfuzję do otaczającej przestrzeni. Zaburzenia tych mechanizmów mogą prowadzić do poważnych konsekwencji funkcjonalnych, co jest wykorzystywane zarówno w terapii farmakologicznej (np. inhibitory wychwytu zwrotnego serotoniny w leczeniu depresji), jak i w toksykologii (np. działanie niektórych trucizn blokujących rozkład acetylocholiny).
Synapsy nie są strukturami statycznymi. W odpowiedzi na aktywność elektryczną i bodźce środowiskowe dochodzi w nich do zmian określanych mianem plastyczności synaptycznej. Plastyczność ta obejmuje zarówno krótkotrwałe modyfikacje siły przewodzenia (np. ułatwienie synaptyczne), jak i długotrwałe zmiany liczby receptorów, wielkości kolbek synaptycznych czy nawet tworzenia i eliminacji całych połączeń. Długotrwałe wzmocnienie (LTP) i długotrwałe osłabienie (LTD) to dwa przeciwstawne procesy uważane za komórkową podstawę uczenia się i pamięci.
Na poziomie molekularnym plastyczność synaptyczna angażuje złożone kaskady sygnalizacyjne, w tym aktywację kinaz białkowych, modyfikacje epigenetyczne oraz zmiany w ekspresji genów. Dane eksperymentalne wskazują, że długotrwałe ślady pamięciowe są utrwalane poprzez zmiany w strukturze synaps, takie jak wzrost liczby kolców dendrytycznych czy zmiany w organizacji cytoszkieletu. Zjawiska te pokazują, że neuron, mimo iż jest komórką zróżnicowaną i pozornie „statyczną”, pozostaje dynamiczną jednostką zdolną do adaptacji przez całe życie organizmu.
Typy neuronów i ich rola w organizmie
Neurony różnią się między sobą budową, lokalizacją, typem przekazywanego sygnału oraz pełnioną funkcją. Ogólnie można wyróżnić neurony czuciowe, ruchowe i interneurony. Neurony czuciowe odbierają bodźce ze środowiska zewnętrznego lub wewnętrznego organizmu za pośrednictwem wyspecjalizowanych receptorów. Dzięki nim możliwe jest odczuwanie dotyku, bólu, temperatury, światła, dźwięku czy położenia ciała w przestrzeni. Informacje te są przekazywane do ośrodkowego układu nerwowego, głównie do rdzenia kręgowego i mózgu.
Neurony ruchowe, zwane motoneuronami, przewodzą pobudzenie z ośrodkowego układu nerwowego do komórek efektorowych, najczęściej mięśni szkieletowych, mięśni gładkich oraz gruczołów. Dzięki nim organizm może wykonywać złożone ruchy, utrzymywać postawę ciała, regulować pracę narządów wewnętrznych i reagować na bodźce. Uszkodzenia motoneuronów prowadzą do poważnych zaburzeń ruchowych, czego przykładem jest stwardnienie zanikowe boczne, choroba neurodegeneracyjna prowadząca do postępującego osłabienia i zaniku mięśni.
Interneurony stanowią ogromną większość neuronów w mózgu i pełnią funkcje integracyjne. Łączą neurony czuciowe z ruchowymi, tworząc łuki odruchowe, oraz tworzą skomplikowane sieci odpowiedzialne za analizę informacji, podejmowanie decyzji, planowanie ruchu, odczuwanie emocji i powstawanie świadomych wrażeń. W obrębie interneuronów występuje ogromne zróżnicowanie pod względem kształtu, rozmiaru, rodzaju neuroprzekaźników oraz właściwości elektrofizjologicznych.
Na podstawie budowy wyróżnia się także neurony jednobiegunowe, dwubiegunowe i wielobiegunowe. Neurony jednobiegunowe posiadają jedną wypustkę, która rozgałęzia się na część aferentną i eferentną; często występują w zwojach czuciowych. Neurony dwubiegunowe, z jednym dendrytem i jednym aksonem, obecne są m.in. w siatkówce oka. Neurony wielobiegunowe, posiadające liczne dendryty i pojedynczy akson, dominują w ośrodkowym układzie nerwowym i odpowiadają za złożone funkcje integracyjne.
Szczególnie interesującą grupę stanowią neurony wyspecjalizowane w przekazywaniu informacji sensorycznych. Przykładem są komórki zwojowe siatkówki, odbierające sygnały z fotoreceptorów i przekazujące je do mózgu za pośrednictwem nerwu wzrokowego. Inny przykład to neurony czuciowe w narządzie Cortiego w uchu wewnętrznym, które przetwarzają drgania mechaniczne na impulsy nerwowe interpretowane przez mózg jako dźwięk. W skórze znajdują się receptory dotyku, takie jak ciałka Meissnera czy Paciniego, których neurony przekazują informacje o nacisku, wibracjach i teksturze.
Mózg człowieka zawiera, według najnowszych szacunków, dziesiątki miliardów neuronów, połączonych ze sobą za pośrednictwem jeszcze większej liczby synaps. W korze mózgowej występują charakterystyczne typy neuronów, m.in. komórki piramidowe, odgrywające zasadniczą rolę w przetwarzaniu informacji i komunikacji między obszarami kory. W móżdżku dominują komórki Purkinjego, o niezwykle rozbudowanej sieci dendrytów, odpowiedzialne za koordynację ruchów i uczenie motoryczne.
Oprócz neuronów pobudzających, które najczęściej wykorzystują glutaminian jako neuroprzekaźnik, kluczową rolę pełnią neurony hamujące, zwykle GABAergiczne. Tworzą one lokalne sieci regulujące poziom pobudzenia i zapobiegające niekontrolowanemu rozprzestrzenianiu się aktywności, jak ma to miejsce w napadach padaczkowych. Zaburzenia w funkcjonowaniu interneuronów hamujących wiązane są z wieloma chorobami neuropsychiatrycznymi, w tym schizofrenią i zaburzeniami ze spektrum autyzmu.
Warto podkreślić, że neurony nie są jedynymi komórkami układu nerwowego. Towarzyszą im liczne komórki glejowe, które zapewniają wsparcie strukturalne, metaboliczne, immunologiczne oraz regulują środowisko zewnątrzkomórkowe. Astrocyty, mikroglej i oligodendrocyty współtworzą z neuronami skomplikowaną sieć, w której przekaz informacji nie ogranicza się wyłącznie do synaps neuron–neuron. Współczesne badania pokazują, że komórki glejowe aktywnie uczestniczą w modulacji transmisji synaptycznej i plastyczności, co poszerza nasze rozumienie funkcjonowania mózgu.
Neuron jako obiekt badań i inspiracja dla sztucznej inteligencji
Od końca XIX wieku neurony stały się centralnym obiektem badań neurobiologii. Dzięki zastosowaniu metod barwienia komórek, takich jak metoda Golgiego, oraz rozwojowi mikroskopii elektronowej, badacze mogli zobaczyć rozbudowaną morfologię neuronów i ich połączeń. W drugiej połowie XX wieku techniki elektrofizjologiczne, w tym metoda patch-clamp, pozwoliły na dokładne pomiary prądów jonowych przepływających przez pojedyncze kanały w błonie komórkowej, co zrewolucjonizowało nasze rozumienie mechanizmów generowania potencjałów czynnościowych.
Równolegle rozwój genetyki i biologii molekularnej umożliwił identyfikację genów kodujących kanały jonowe, receptory i białka zaangażowane w sygnalizację wewnątrzkomórkową. Dzięki temu neurony stały się modelem do badania mutacji prowadzących do kanałopatii, czyli chorób wynikających z nieprawidłowego działania kanałów jonowych. Przykładami takich schorzeń są niektóre formy epilepsji czy dziedziczne zaburzenia rytmu serca, w których neurony i komórki mięśnia sercowego wykazują zmienioną pobudliwość.
Współczesna neuronauka korzysta z wielu zaawansowanych technik obrazowania. Mikroskopia dwufotonowa pozwala obserwować aktywność pojedynczych neuronów w żywym mózgu, a znakowanie białkami fluorescencyjnymi umożliwia śledzenie szlaków projekcji aksonów. Z kolei metody neuroobrazowania, takie jak funkcjonalny rezonans magnetyczny, pozwalają badać aktywność całych obszarów mózgu podczas wykonywania zadań poznawczych. Dane te są następnie integrowane z wiedzą na poziomie komórkowym, tworząc wielopoziomowy obraz funkcjonowania układu nerwowego.
Neuron stał się również inspiracją dla rozwoju sztucznej inteligencji. W modelach komputerowych tzw. neuronów sztucznych uproszczono właściwości komórek biologicznych do podstawowych operacji matematycznych: sumowania sygnałów wejściowych, ważenia ich znaczenia i zastosowania funkcji aktywacji. Sieci złożone z wielu takich jednostek, zwane sieciami neuronowymi, potrafią uczyć się rozpoznawania wzorców, klasyfikacji danych czy przewidywania wyników na podstawie przykładów. Choć sztuczne neurony są bardzo uproszczonymi analogami swoich biologicznych odpowiedników, ich sukcesy w dziedzinie uczenia maszynowego podkreślają ogólną skuteczność zasady przetwarzania równoległego i rozproszonego.
Jednocześnie porównanie mózgu biologicznego i architektur sztucznych sieci neuronowych uwydatnia ograniczenia obecnych modeli. Pojedynczy neuron biologiczny jest znacznie bardziej złożony niż jednostka w typowej sieci neuronowej, posiada setki typów kanałów jonowych, liczne szlaki sygnalizacyjne i skomplikowaną geometrię dendrytów. Neurony mogą wykonywać lokalne obliczenia w obrębie pojedynczych gałęzi dendrytycznych, co sprawia, że możliwości przetwarzania informacji są bogatsze niż w prostych modelach sumujących wejścia.
Badania nad neuronami wnoszą również istotny wkład do medycyny. Zrozumienie mechanizmów neurodegeneracji, takich jak w chorobie Alzheimera, Parkinsona czy stwardnieniu rozsianym, wymaga szczegółowej analizy zmian w funkcjonowaniu i przeżywalności neuronów oraz komórek glejowych. W chorobie Alzheimera obserwuje się gromadzenie patologicznych białek, prowadzące do uszkodzenia synaps i śmierci neuronów w kluczowych obszarach odpowiedzialnych za pamięć. W stwardnieniu rozsianym dochodzi do demielinizacji aksonów, co upośledza przewodzenie impulsów i prowadzi do objawów neurologicznych o różnym nasileniu.
W dziedzinie terapii eksperymentalnych badacze starają się pobudzać neurogenezę, czyli powstawanie nowych neuronów z komórek macierzystych, oraz wspomagać regenerację aksonów po urazach rdzenia kręgowego. O ile w obwodowym układzie nerwowym regeneracja jest możliwa w ograniczonym zakresie, o tyle w ośrodkowym układzie nerwowym ssaków zdolność ta jest bardzo niewielka. Dlatego też jednym z kluczowych wyzwań współczesnej neurobiologii jest znalezienie sposobów na przywracanie połączeń neuronalnych po uszkodzeniach oraz łagodzenie skutków chorób neurodegeneracyjnych.
Neuron jest zatem zarówno podstawową jednostką strukturalną układu nerwowego, jak i nośnikiem informacji, pamięci oraz tożsamości organizmu. Każda komórka nerwowa, poprzez swoją unikalną kombinację połączeń synaptycznych, poziomów ekspresji genów i właściwości elektrycznych, wnosi wkład w funkcjonowanie całej sieci. Wzorce aktywności milionów neuronów współdziałających w czasie i przestrzeni leżą u podstaw czynności tak różnorodnych jak odruch cofnięcia ręki od gorącego przedmiotu, planowanie ruchu, odczuwanie emocji czy formułowanie myśli abstrakcyjnych.
Zrozumienie neuronu nie jest więc jedynie zagadnieniem z obszaru biologii komórkowej. To punkt wyjścia do badania świadomości, zachowania, uczenia się, języka i kultury. Analiza funkcjonowania pojedynczych neuronów oraz całych sieci neuronalnych dostarcza narzędzi do lepszego diagnozowania i leczenia chorób układu nerwowego, projektowania nowych metod komunikacji człowiek–komputer oraz tworzenia bardziej zaawansowanych algorytmów sztucznej inteligencji. W tym sensie neuron pozostaje jednym z najważniejszych obiektów badań współczesnej nauki, łącząc w sobie zagadnienia biologii, medycyny, informatyki i filozofii umysłu.
FAQ: Najczęściej zadawane pytania o neurony
Czym neuron różni się od innych komórek ciała?
Neuron wyróżnia się zdolnością do generowania i przewodzenia impulsów elektrycznych oraz tworzenia wyspecjalizowanych połączeń – synaps. Ma rozbudowane wypustki (dendryty i akson), które pozwalają tworzyć złożone sieci. W odróżnieniu od wielu komórek ciała, większość neuronów po osiągnięciu dojrzałości nie dzieli się, a ich uszkodzenie bywa często nieodwracalne, co ma ogromne znaczenie dla przebiegu chorób neurologicznych.
Czy neurony mogą się regenerować i odrastać?
Możliwości regeneracji neuronów zależą od lokalizacji. W obwodowym układzie nerwowym uszkodzone aksony mogą odrastać na ograniczoną odległość, zwłaszcza przy wsparciu komórek Schwanna. W ośrodkowym układzie nerwowym ssaków, czyli w mózgu i rdzeniu kręgowym, zdolność ta jest znacznie mniejsza. Istnieją jednak obszary, w których zachodzi neurogeneza, np. w hipokampie. Trwają intensywne badania mające zwiększyć regenerację neuronów po urazach i w chorobach neurodegeneracyjnych.
Jak neurony tworzą pamięć?
Pamięć nie jest przechowywana w jednym „miejscu”, lecz w rozproszonych sieciach neuronów. Kluczową rolę odgrywa plastyczność synaptyczna – trwałe zmiany w sile połączeń między neuronami. Powtarzająca się wspólna aktywność prowadzi do wzmocnienia niektórych synaps (LTP) i osłabienia innych (LTD). Z czasem zmienia się liczba receptorów, struktura kolców dendrytycznych i ekspresja genów. W efekcie ta sama sieć neuronów reaguje inaczej na bodźce, co przejawia się jako utrwalony ślad pamięciowy, dostępny podczas przypominania informacji.
Dlaczego choroby neuronów są tak trudne w leczeniu?
Neurony są silnie wyspecjalizowane, słabo się dzielą i często mają bardzo długie aksony, co utrudnia ich zastąpienie po uszkodzeniu. Dodatkowo mózg i rdzeń kręgowy są chronione barierami (np. bariera krew–mózg), które utrudniają dostarczanie leków. Wiele chorób neurologicznych wynika z złożonych interakcji genetycznych i środowiskowych, obejmujących nie tylko neurony, ale także komórki glejowe i naczynia krwionośne. Dlatego terapie muszą być precyzyjne, długotrwałe i często łączyć farmakologię, rehabilitację oraz nowoczesne metody biologii molekularnej.
Czy sztuczne neurony w komputerach działają jak prawdziwe neurony?
Sztuczne neurony są jedynie uproszczonym modelem matematycznym komórek nerwowych. Wykonują proste operacje: sumują sygnały wejściowe, stosują wagi i funkcję aktywacji, a następnie przekazują wynik dalej w sieci. Brakuje im złożonej geometrii, różnorodności kanałów jonowych, plastyczności synaptycznej na poziomie molekularnym i interakcji z komórkami glejowymi. Mimo to sieci zbudowane z takich jednostek potrafią rozwiązywać wiele zadań, inspirując się ogólną zasadą działania mózgu, choć nie odtwarzają wiernie biologicznych procesów.