Telomery fascynują biologów, lekarzy i biotechnologów, ponieważ łączą w sobie zagadnienia dziedziczenia, starzenia się organizmów i powstawania chorób, w tym nowotworów. Zrozumienie ich budowy oraz sposobu działania pozwala spojrzeć na komórkę nie jak na statyczną strukturę, lecz na dynamiczny system, który musi nieustannie chronić swój materiał genetyczny przed degradacją i utratą informacji. Telomery są jednym z kluczowych mechanizmów tej ochrony, a ich badanie otwiera drogę do nowych strategii terapeutycznych.
Budowa i lokalizacja telomerów w komórce
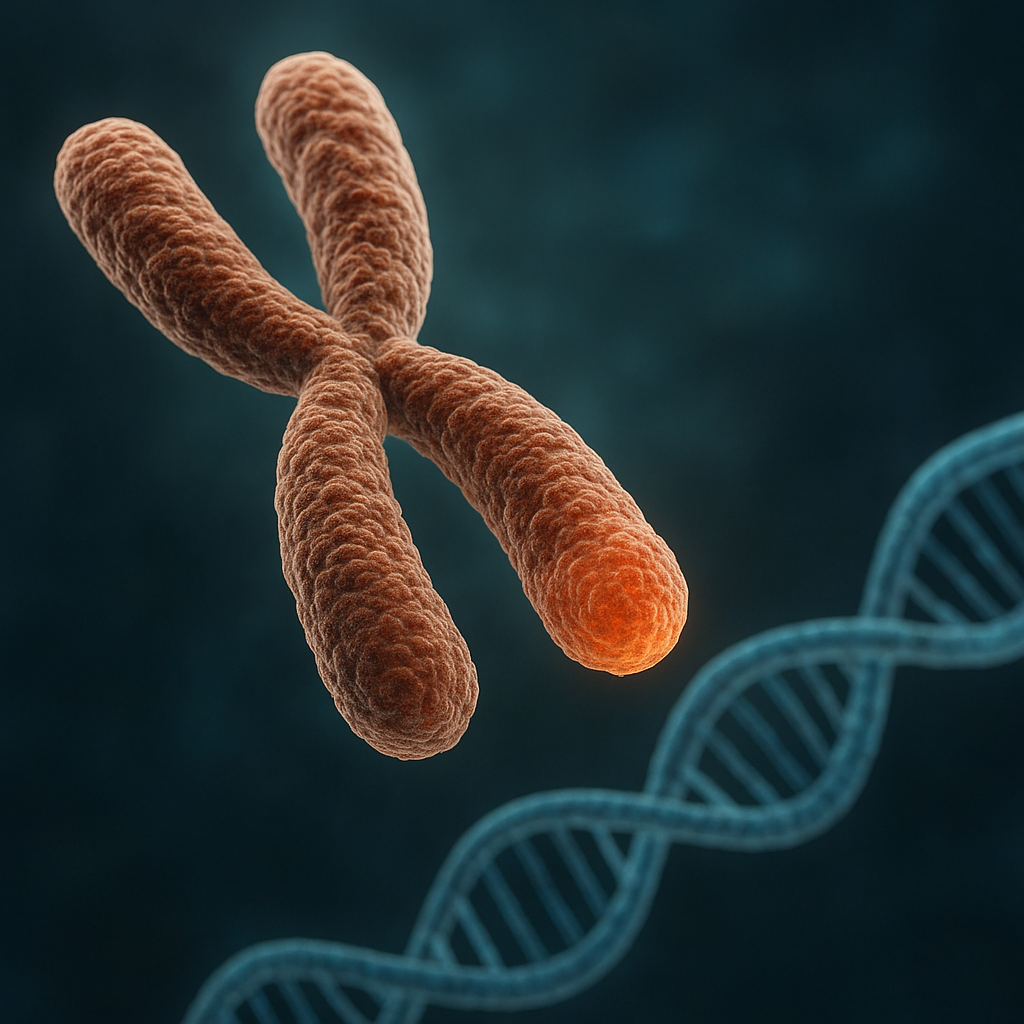
Telomer to specjalistyczny odcinek DNA zlokalizowany na końcach chromosomów eukariotycznych. U człowieka składa się z wielu powtórzeń krótkiej sekwencji nukleotydów TTAGGG, ułożonych dziesiątki tysięcy razy jeden po drugim. Taka powtarzalna struktura tworzy rodzaj genetycznego „bufora bezpieczeństwa”, który może ulegać skracaniu bez bezpośredniej utraty ważnych informacji genetycznych. Telomery nie kodują białek, ale pełnią funkcję strukturalno–ochronną.
Chromosomy są zbudowane z DNA oraz powiązanych z nim białek histonowych i niehistonowych. W ich wnętrzu znajdują się geny kodujące białka i RNA, natomiast na końcach ulokowane są właśnie telomery. Dzięki specyficznej sekwencji oraz towarzyszącym im białkom telomery przybierają unikatową strukturę trójwymiarową. Końcówka DNA może tworzyć pętlę (tzw. T-loop), w której fragment nici jednoniciowej zawija się i wnika w część dwuniciową, co stabilizuje całą końcową strukturę chromosomu.
Istotnym elementem telomerów są białka tworzące kompleks osłonowy, często nazywany shelterin. W jego skład wchodzi kilka wyspecjalizowanych białek, takich jak TRF1, TRF2, POT1, TIN2, TPP1 i RAP1. Przyłączają się one specyficznie do powtórzeń telomerowych i regulują zarówno długość telomerów, jak i dostępność końców DNA dla innych białek komórkowych. To właśnie shelterin odpowiada za to, że komórka nie myli zakończeń chromosomów z przypadkowymi pęknięciami DNA.
Telomery są szczególnie istotne w komórkach, które intensywnie się dzielą, takich jak komórki nabłonka jelit, skóry czy komórki krwiotwórcze szpiku kostnego. W tych tkankach obserwuje się ciągłą potrzebę odnawiania komórek, a więc także częste kopiowanie DNA. Bez telomerów końce chromosomów byłyby narażone na stopniową utratę fragmentów istotnych genów przy każdym podziale, co szybko prowadziłoby do utraty funkcji tkanek, zaburzeń metabolicznych i groźnych mutacji.
Na poziomie strukturalnym telomer nie jest więc pojedynczym, prostym „ogonkiem” DNA, ale złożonym układem wielokrotnych powtórzeń nukleotydów, specyficznych białek ochronnych oraz trójwymiarowej organizacji przestrzennej. Dzięki temu może pełnić rolę zarówno fizycznej bariery dla enzymów degradujących DNA, jak i sygnalizatora kontrolującego, jak długo dana komórka może bezpiecznie się dzielić.
Funkcje telomerów i ich znaczenie dla stabilności genomu
Podstawową funkcją telomerów jest ochrona końców chromosomów przed niekontrolowanymi reakcjami naprawczymi i fuzją z innymi fragmentami DNA. Koniec liniowego DNA mógłby zostać rozpoznany przez systemy naprawy jako groźne pęknięcie dwuniciowe. W takiej sytuacji uruchomiłaby się odpowiedź na uszkodzenie DNA, skutkująca albo sczepieniem końców z innymi chromosomami, albo zatrzymaniem cyklu komórkowego i śmiercią komórki. Telomery maskują te końce, dzięki czemu chromosomy zachowują integralność.
Podczas replikacji DNA działa tzw. problem replikacji końców (end replication problem). Enzym odpowiedzialny za kopiowanie DNA, polimeraza DNA, wymaga krótkiego startera RNA i nie jest w stanie dobudować ostatniego fragmentu nici na samym końcu. W efekcie każda runda replikacji prowadzi do minimalnego skrócenia telomera. To zjawisko jest nieuniknione przy liniowej organizacji genomu i stanowi podstawę komórkowego licznika podziałów.
Telomery działają jak biologiczny „zegar”: im krótsze, tym więcej podziałów ma za sobą dana komórka. Po przekroczeniu krytycznie krótkiej długości telomery przestają zapewniać skuteczną ochronę. Wtedy końce chromosomów są rozpoznawane jako uszkodzone DNA, aktywują się szlaki nadzorujące prawidłowość genomu, m.in. p53, a komórka wchodzi w stan starzenia komórkowego (senescencji) lub ulega zaprogramowanej śmierci. Jest to mechanizm zabezpieczający organizm przed nadmierną proliferacją uszkodzonych komórek.
Z punktu widzenia stabilności genomu, odpowiednia długość telomerów jest kluczowa. Zbyt krótkie telomery sprzyjają powstawaniu nieprawidłowych połączeń między chromosomami, translokacji czy delecji, czyli zmian w strukturze chromosomów prowadzących do mutacji. Z kolei nadmiernie wydłużone, niekontrolowane telomery mogą umożliwiać komórkom wielokrotnie przekraczanie normalnej liczby podziałów, co zwiększa prawdopodobieństwo nagromadzenia groźnych mutacji.
Telomery pełnią również funkcję regulacyjną w stosunku do ekspresji niektórych genów. Zjawisko to określa się jako „position effect” lub bardziej specyficznie TPE (Telomere Position Effect). Położenie genu w pobliżu regionu telomerowego może wpływać na stopień jego wyciszenia lub aktywności. Zmiana długości telomerów, a więc i organizacji chromatyny w ich sąsiedztwie, może zatem pośrednio modulować profil ekspresji genów w komórce.
Istnieją dowody, że telomery są szczególnie wrażliwe na czynniki stresowe, takie jak stres oksydacyjny, stan zapalny czy ekspozycja na toksyczne związki chemiczne. Reaktywne formy tlenu uszkadzają zasady azotowe w rejonie telomerowym, co przyspiesza ich skracanie, ponieważ mechanizmy naprawcze działają tam mniej wydajnie niż w innych częściach genomu. Oznacza to, że styl życia oraz środowisko, w jakim żyje organizm, wpływają na tempo zużywania się telomerów.
Rola telomerów wykracza więc poza prostą ochronę końców DNA. Stanowią one element złożonej sieci kontrolującej cykl komórkowy, odpowiedź na uszkodzenia DNA oraz równowagę między proliferacją a starzeniem komórek. Utrzymanie właściwej długości telomerów jest niezbędne dla zachowania stabilności genomu i unikania chorób wynikających z jego destabilizacji, w tym szczególnie nowotworów i niektórych chorób degeneracyjnych.
Telomeraza – enzym podtrzymujący długość telomerów
Kluczowym elementem regulacji długości telomerów jest enzym o nazwie telomeraza. Jest to polimeraza odwrotna, czyli enzym zdolny do przepisywania informacji z RNA na DNA. Telomeraza wykorzystuje własną cząsteczkę RNA jako matrycę do dobudowywania powtórzeń TTAGGG na końcach chromosomów. Dzięki temu może częściowo kompensować skracanie zachodzące przy każdym cyklu replikacji.
Telomeraza składa się z kilku podjednostek, spośród których najważniejsze są podjednostka katalityczna TERT (telomerase reverse transcriptase) oraz składnik RNA – TER lub TERC, zawierający sekwencję komplementarną do powtórzeń telomerowych. TERT dołącza się do końca jednoniciowego DNA, a następnie, odczytując matrycę RNA, syntetyzuje kolejne powtórzenia nukleotydów, wydłużając w ten sposób telomer.
W większości somatycznych komórek człowieka aktywność telomerazy jest bardzo niska lub niemal nieobecna. Wyjątek stanowią komórki macierzyste, komórki zarodkowe i niektóre komórki progenitorowe, które potrzebują większego potencjału podziałowego, aby zapewniać odnowę tkanek przez całe życie organizmu. Tam telomeraza działa jako mechanizm zabezpieczający przed zbyt szybkim skracaniem telomerów.
Brak aktywnej telomerazy w typowych komórkach somatycznych jest uważany za ewolucyjną strategię ochronną przed niekontrolowaną proliferacją. Gdyby wszystkie komórki miały zdolność ciągłego odnawiania telomerów, łatwiej mogłyby przekształcić się w komórki nowotworowe, ignorując sygnały ograniczające liczbę podziałów. Z tego powodu ścisła regulacja aktywności telomerazy ma ogromne znaczenie dla utrzymania równowagi między regeneracją tkanek a zapobieganiem nowotworom.
Istnieją także alternatywne mechanizmy wydłużania telomerów, określane zbiorczo jako ALT (Alternative Lengthening of Telomeres). Opierają się one na procesach rekombinacji homologicznej między różnymi końcami chromosomów. Mechanizmy ALT są typowe dla części nowotworów, w których telomeraza pozostaje nieaktywna, ale komórki i tak potrafią obejść ograniczenia narzucane przez skracanie telomerów.
Badania nad kontrolą aktywności telomerazy są jednym z najaktywniejszych obszarów współczesnej biologii molekularnej i medycyny. Z jednej strony naukowcy próbują opracować metody selektywnego hamowania tego enzymu w komórkach nowotworowych, co mogłoby doprowadzić do ich stopniowego „zużywania się” i śmierci. Z drugiej strony poszukuje się bezpiecznych sposobów umiarkowanego zwiększania aktywności telomerazy w komórkach zdrowych, np. w celu spowolnienia procesów starzeniowych tkanek.
Telomeraza stanowi więc swoiste „narzędzie regulacyjne” długości telomerów. Jej działanie musi być ściśle dozowane i przestrzennie kontrolowane, aby utrzymać delikatną równowagę pomiędzy zdolnością do odnowy a ryzykiem nieograniczonej proliferacji. Zaburzenia w ekspresji TERT lub w budowie składnika RNA telomerazy prowadzą do rzadkich, ale bardzo poważnych chorób, takich jak wrodzone zespoły niewydolności szpiku, które są żywym dowodem na to, jak krytyczna jest prawidłowa funkcja tego enzymu.
Telomery a proces starzenia organizmu
Skracanie telomerów na przestrzeni życia organizmu jest jednym z najlepiej udokumentowanych biomarkerów starzenia na poziomie komórkowym. W miarę kolejnych podziałów komórek, a także pod wpływem czynników środowiskowych, długość telomerów stopniowo się zmniejsza. Gdy osiągną minimalną, krytyczną długość, komórki wchodzą w fazę senescencji, w której przestają się dzielić, ale wciąż pozostają metabolicznie aktywne.
Komórki w stanie senescencji zmieniają swój profil wydzielniczy, zaczynają produkować liczne cytokiny prozapalne, proteazy i czynniki wzrostu. Zjawisko to określa się jako SASP (Senescence-Associated Secretory Phenotype). Nagromadzenie takich komórek w tkankach sprzyja przewlekłemu stanowi zapalnemu, zaburza funkcjonowanie otoczenia komórkowego i może przyczyniać się do rozwoju chorób związanych z wiekiem, takich jak miażdżyca, sarkopenia czy choroby neurodegeneracyjne.
Badania populacyjne wykazały, że osoby o krótszych telomerach leukocytów krwi obwodowej częściej zapadają na choroby sercowo-naczyniowe, cukrzycę typu 2 oraz niektóre nowotwory. Obserwuje się również korelację między tempem skracania telomerów a przewidywaną długością życia, choć zależność ta jest złożona i modyfikowana przez liczne czynniki genetyczne i środowiskowe.
Genetyczna długość telomerów jest częściowo dziedziczona – dzieci rodziców z długimi telomerami mają na ogół dłuższe telomery już na starcie. Jednak późniejsze tempo ich skracania zależy od stylu życia i narażenia na niekorzystne czynniki. Przewlekły stres psychologiczny, brak snu, palenie tytoniu, dieta bogata w przetworzone produkty i zanieczyszczenia środowiskowe przyspieszają utratę powtórzeń telomerowych. Z kolei aktywność fizyczna, dieta bogata w antyoksydanty, utrzymywanie prawidłowej masy ciała i ograniczanie stresu wiążą się z wolniejszym skracaniem telomerów.
Telomery nie są jednak jedynym mechanizmem starzenia. Proces ten obejmuje także akumulację mutacji w DNA, uszkodzenia mitochondriów, zmiany epigenetyczne i wiele innych czynników. Dlatego próby modyfikowania wyłącznie długości telomerów nie zlikwidują całkowicie starzenia, choć mogą wpłynąć na pewne jego aspekty, szczególnie związane z funkcją tkanek o wysokiej rotacji komórek.
Eksperymenty na modelach zwierzęcych, w których manipulowano aktywnością telomerazy, przyniosły interesujące wyniki. Myszy z nadekspresją TERT wykazywały w niektórych warunkach wydłużenie życia i opóźnienie objawów starzenia, o ile jednocześnie silnie chroniono je przed rozwojem nowotworów. Z kolei myszy pozbawione sprawnej telomerazy szybciej starzały się na poziomie tkanek, szczególnie w szpiku, układzie pokarmowym i rozrodczym. To potwierdza, że telomery są istotnym, choć nie jedynym, elementem układanki starzenia się organizmu.
Zainteresowanie wpływem stylu życia na długość telomerów doprowadziło do rozwoju wielu programów badawczych, w których analizuje się wpływ medytacji, technik redukcji stresu, diety roślinnej czy umiarkowanego wysiłku aerobowego na dynamikę telomerów u ludzi. W części badań obserwowano spowolnienie ich skracania, a nawet niewielkie wydłużenie u osób, które radykalnie zmieniły nawyki. Mechanizmy tego efektu nie są jeszcze w pełni poznane, ale prawdopodobnie obejmują redukcję stresu oksydacyjnego i stanów zapalnych.
Choć modyfikowanie telomerów stało się popularnym hasłem w nurcie medycyny anti-aging, nauka podkreśla konieczność ostrożności. Nadmierna aktywacja telomerazy, szczególnie u osób dorosłych, może zwiększać ryzyko onkogenezy. Dlatego obecnie bardziej realistycznym i bezpieczniejszym podejściem jest dbanie o warunki środowiskowe komórek – poprzez zdrowy styl życia – niż bezpośrednia manipulacja samymi telomerami za pomocą niezweryfikowanych suplementów czy terapii.
Telomery w chorobach nowotworowych i innych patologiach
Nowotwory charakteryzują się niemal nieograniczoną zdolnością do podziałów, co wymaga przełamania naturalnej bariery, jaką jest skracanie telomerów. W wielu typach nowotworów obserwuje się reaktywację telomerazy. Komórki rakowe zaczynają ponownie produkować TERT, wydłużając telomery na tyle, by ominąć sygnały starzenia komórkowego i apoptozy. Dzięki temu uzyskują potencjał „nieśmiertelności” i mogą dzielić się praktycznie bez końca.
Inne nowotwory korzystają z mechanizmu ALT, w którym dochodzi do rekombinacji między fragmentami telomerów różnych chromosomów. Także w tym przypadku celem jest obejście ograniczeń wynikających z krótkich telomerów. Co ciekawe, komórki wykorzystujące ALT często charakteryzują się bardzo niestabilnym genomem, co może sprzyjać dalszej ewolucji nowotworu i oporności na leczenie.
Telomery odgrywają również rolę w grupie rzadkich chorób nazywanych zbiorczo telomeropatiami. Należą do nich m.in. dyskeratosis congenita, niektóre postacie idiopatycznego włóknienia płuc, wrodzone zespoły niewydolności szpiku oraz pewne formy marskości wątroby. Pacjenci z tymi schorzeniami mają silnie skrócone telomery z powodu mutacji w genach kodujących komponenty telomerazy lub białka kompleksu shelterin.
Konsekwencją patologicznego skrócenia telomerów jest przedwczesne wyczerpanie potencjału podziałowego komórek macierzystych w kluczowych tkankach. W szpiku kostnym prowadzi to do niewydolności hematopoezy, w płucach do włóknienia miąższu, a w wątrobie do zaburzeń regeneracji. Choroby te dają kliniczny obraz przyspieszonego starzenia się określonych tkanek i potwierdzają fundamentalne znaczenie telomerów dla utrzymania długotrwałej wydolności organizmu.
Paradoksalnie, zarówno zbyt krótkie, jak i niekontrolowanie wydłużone telomery mogą sprzyjać powstawaniu nowotworów, choć na różne sposoby. W pierwszym przypadku skrócenie prowadzi do niestabilności genomu i zwiększonej szansy na akumulację mutacji inicjujących proces nowotworzenia. W drugim – nadmierna aktywność telomerazy umożliwia przetrwanie i ekspansję już zmutowanych komórek. To napięcie między ochroną przed starzeniem a ochroną przed nowotworami stanowi jeden z najbardziej złożonych dylematów biologii telomerów.
W praktyce klinicznej pomiar długości telomerów bywa wykorzystywany jako element diagnostyki w podejrzeniu telomeropatii oraz w niektórych badaniach prognostycznych. Analiza telomerów leukocytów może dostarczyć informacji o potencjalnym ryzyku powikłań lub o stanie starzenia immunologicznego pacjenta, choć nie jest to jeszcze rutynowe narzędzie w standardowej opiece medycznej.
W świetle tych danych telomery jawią się jako newralgiczny punkt równowagi między zdolnością tkanek do regeneracji a ryzykiem ich transformacji nowotworowej. Zrozumienie, w jaki sposób komórki zdrowe i nowotworowe różnie regulują mechanizmy wydłużania telomerów, otwiera drogę do projektowania terapii, które będą selektywnie uderzać w komórki raka, oszczędzając jednocześnie komórki zdrowe.
Możliwości terapeutyczne i wyzwania badawcze
Perspektywa celowania w telomery i telomerazę w celu leczenia chorób jest niezwykle pociągająca, ale jednocześnie pełna trudności. W onkologii rozważane są strategie farmakologicznego hamowania telomerazy w komórkach nowotworowych. Inhibitory tego enzymu miałyby stopniowo skracać telomery komórek raka, doprowadzając do ich wejścia w senescencję lub apoptozę. Problemem jest jednak fakt, że efekt pojawiałby się dopiero po wielu podziałach, co może być zbyt wolnym procesem w szybko rosnących nowotworach.
Inną możliwością jest bezpośrednie uszkadzanie struktury telomerów lub zaburzanie funkcji kompleksu shelterin, tak aby końce chromosomów nowotworowych stały się widoczne dla mechanizmów odpowiedzi na uszkodzenia DNA. Taka strategia mogłaby bardziej gwałtownie zatrzymać proliferację komórek raka, ale niesie ryzyko toksyczności wobec komórek zdrowych, szczególnie tych o wysokiej częstości podziałów, jak komórki krwi czy nabłonka jelit.
W przypadku chorób związanych z niedoborem długości telomerów rozważa się strategie odwrotne – tymczasową aktywację telomerazy lub dostarczanie komponentów niezbędnych do utrzymania telomerów. Badania nad terapiami genowymi, w których do komórek wprowadza się prawidłowy gen TERT lub TERC, znajdują się na etapie wstępnym, ale dają nadzieję na poprawę funkcji szpiku czy płuc w niektórych telomeropatiach. Kluczowe jest tu jednak zachowanie ścisłej kontroli nad zakresem i czasem działania takiej terapii.
Intensywnie bada się także związki naturalne oraz syntetyczne, które mogłyby pośrednio wpływać na stabilność telomerów poprzez redukcję stresu oksydacyjnego, wspieranie naprawy DNA lub modulację epigenetyczną regionów telomerowych. Zainteresowanie budzą m.in. polifenole roślinne, substancje o działaniu antyoksydacyjnym, a także niektóre leki kardiologiczne, którym przypisuje się działanie ochronne na genom. Większość tych obserwacji pochodzi jednak z badań przedklinicznych i wymaga potwierdzenia w dużych, kontrolowanych badaniach u ludzi.
Dużym wyzwaniem badawczym jest precyzyjny pomiar długości telomerów i jej zmian w czasie. Stosuje się różnorodne techniki, od klasycznej hybrydyzacji in situ (Q-FISH), przez metody oparte na PCR, po najnowsze podejścia sekwencjonowania wysokoprzepustowego. Każda z metod ma swoje ograniczenia dotyczące czułości, powtarzalności i kosztów. Dodatkową trudnością jest fakt, że długość telomerów różni się między tkankami tego samego organizmu i zmienia się wraz z wiekiem, co utrudnia interpretację pojedynczych pomiarów.
Ważnym kierunkiem badań jest także lepsze poznanie interakcji między telomerami a epigenetyką. Regiony telomerowe są bogate w specyficzne modyfikacje histonów i metylację DNA, które wpływają na stopień kondensacji chromatyny. Zmiany w tych oznaczeniach epigenetycznych mogą wpływać zarówno na stabilność strukturalną telomerów, jak i na aktywność genów sąsiadujących z nimi. Zrozumienie tego poziomu regulacji może pozwolić na subtelniejsze i bezpieczniejsze interwencje niż bezpośrednia manipulacja telomerazą.
Obecnie realne, praktyczne rekomendacje dotyczące ochrony telomerów koncentrują się przede wszystkim na stylu życia. Utrzymywanie umiarkowanej aktywności fizycznej, dieta bogata w warzywa, owoce i zdrowe tłuszcze, unikanie palenia, ochrona przed nadmiernym promieniowaniem UV, redukcja przewlekłego stresu i odpowiednia ilość snu – wszystkie te działania sprzyjają ograniczeniu stresu oksydacyjnego oraz przewlekłego stanu zapalnego. W efekcie mogą pośrednio spowalniać tempo skracania telomerów, wspierając długoterminową homeostazę organizmu.
Znaczenie telomerów dla biologii ewolucyjnej i przyszłych badań
Telomery są nie tylko istotne z punktu widzenia medycyny, ale także dla zrozumienia procesów ewolucyjnych. Różne gatunki wykazują odmienną długość telomerów i różną aktywność telomerazy, co może mieć związek z ich strategią życia, długością życia oraz tempem rozrodu. Niektóre gatunki długowieczne, jak pewne gatunki ptaków czy ssaków morskich, utrzymują stabilne telomery przez długi czas pomimo wysokiej masy ciała, co stanowi wyzwanie dla prostych modeli łączących telomery wyłącznie z wiekiem.
Analiza porównawcza międzygatunkowa sugeruje, że ewolucja balansuje między potrzebą regeneracji tkanek a koniecznością ograniczenia ryzyka nowotworów. Gatunki o szybkiej reprodukcji i krótkim życiu często wykazują wyższą aktywność telomerazy w szerokim spektrum tkanek, co ułatwia im intensywny wzrost i rozmnażanie. Z kolei gatunki długowieczne, w tym człowiek, ograniczyły aktywność telomerazy do wąskich populacji komórek macierzystych, zmniejszając w ten sposób ryzyko nowotworów kosztem rosnącej roli starzenia tkanek.
Telomery mogą też wpływać na zjawiska związane z historią życia jednostki, takie jak tempo wzrostu w okresie wczesnego rozwoju, zdolność regeneracji po urazach czy odporność na stres. W badaniach na dzikich populacjach zwierzęcych wykazano, że osobniki z krótszymi telomerami częściej wykazują gorsze przeżycie w kolejnych sezonach, co potwierdza biologiczne znaczenie tej struktury poza warunkami laboratoryjnymi.
Przyszłe badania będą prawdopodobnie łączyć analizy telomerów z innymi wskaźnikami starzenia komórkowego, takimi jak sygnatury metylacji DNA, uszkodzenia mitochondriów czy profile transkryptomiczne. Pozwoli to stworzyć wielowymiarowe modele starzenia, w których telomery będą jednym z wielu, ale dobrze scharakteryzowanych elementów. Coraz większą rolę odegra również bioinformatyka i modele matematyczne opisujące dynamikę telomerów w populacjach komórek i całych organizmach.
Istnieje także rosnące zainteresowanie wpływem środowiska społecznego na dynamikę telomerów u ludzi. Badania sugerują, że czynniki takie jak poziom wsparcia społecznego, doświadczenia traumatyczne, status ekonomiczny czy ekspozycja na przemoc w dzieciństwie korelują z długością telomerów w wieku dorosłym. Łączy to biologię molekularną z naukami społecznymi, pokazując, że warunki życia przekładają się na fizyczny stan struktur tak fundamentalnych jak telomery.
W miarę rozwoju metod sekwencjonowania i edycji genomu stanie się możliwe coraz dokładniejsze badanie indywidualnych różnic w genach regulujących telomery. Pozwoli to lepiej zrozumieć, dlaczego niektóre osoby zachowują relatywnie długie telomery mimo niekorzystnych warunków środowiskowych, podczas gdy inne wykazują przyspieszone ich skracanie. Być może w przyszłości wiedza ta zostanie wykorzystana w spersonalizowanej medycynie prewencyjnej i strategiach ochrony zdrowia.
Telomery pozostają więc obszarem intensywnych poszukiwań na przecięciu biologii komórki, medycyny, epidemiologii, ekologii ewolucyjnej i nauk społecznych. Każde nowe odkrycie dotyczące ich budowy, funkcji czy regulacji wnosi kolejne elementy do obrazu organizmu jako dynamicznego systemu, który musi nieustannie godzić sprzeczne wymagania – wzrostu, regeneracji, obrony przed chorobami i zachowania integralności genetycznej w zmiennym środowisku.
FAQ – najczęstsze pytania o telomery
Czy długość telomerów można wiarygodnie zbadać u każdego człowieka?
Istnieją metody laboratoryjne pozwalające ocenić średnią długość telomerów, najczęściej w leukocytach krwi. Wynik bywa jednak trudny w interpretacji, bo telomery różnią się między tkankami, a ich długość zmienia się wraz z wiekiem i pod wpływem środowiska. Pomiary wykonywane w celach komercyjnych często nie są standaryzowane. Obecnie w medycynie klinicznej stosuje się je głównie przy podejrzeniu telomeropatii, a nie jako rutynowy test „wieku biologicznego”.
Czy można bezpiecznie wydłużyć telomery za pomocą suplementów?
Wiele suplementów reklamuje się jako wydłużające telomery, ale dowody naukowe na taki efekt są ograniczone i często pochodzą z badań in vitro lub na zwierzętach. U ludzi lepiej udokumentowane jest raczej spowalnianie skracania telomerów przez zdrowy styl życia niż ich faktyczne wydłużanie. Bezpośrednia aktywacja telomerazy może zwiększać ryzyko nowotworów, dlatego nie zaleca się stosowania preparatów o niezweryfikowanym działaniu, szczególnie u osób dorosłych, bez ścisłej kontroli medycznej.
Dlaczego telomery skracają się szybciej u niektórych osób?
Tempo skracania telomerów zależy od kombinacji czynników genetycznych i środowiskowych. Część osób dziedziczy krótsze telomery lub słabszą efektywność mechanizmów naprawy DNA. Duże znaczenie mają też warunki życia: palenie papierosów, otyłość, przewlekły stres, zanieczyszczenia, brak snu i aktywności fizycznej nasilają stres oksydacyjny i stan zapalny, przyspieszając utratę powtórzeń telomerowych. Z kolei zbilansowana dieta, ruch i redukcja stresu mogą ten proces istotnie spowolnić.
Czy długość telomerów naprawdę określa długość życia?
Telomery są jednym z ważnych biomarkerów starzenia, ale nie jedynym i nie determinują długości życia w sposób absolutny. Osoby z krótszymi telomerami częściej chorują na schorzenia związane z wiekiem, co może skracać życie, jednak wpływ mają też inne procesy: uszkodzenia mitochondriów, zmiany epigenetyczne, styl życia czy dostęp do opieki medycznej. Długość telomerów można traktować jako wskaźnik obciążenia organizmu, lecz nie jako niezmienny „wyrok” dotyczący przewidywanej długości życia.
Czy dzieci dziedziczą długość telomerów po rodzicach?
Długość telomerów ma istotny komponent dziedziczny – obserwuje się korelację między długością telomerów rodziców a ich potomstwa. Znaczenie ma zarówno materiał genetyczny związany z regulacją telomerazy, jak i stan komórek rozrodczych rodziców w momencie poczęcia. Mimo to po urodzeniu na dynamikę telomerów silnie wpływają czynniki środowiskowe: odżywianie, infekcje, stres, warunki socjoekonomiczne. Dziedziczenie daje więc punkt wyjścia, ale nie przesądza o całym dalszym przebiegu zmian.