Telomeraza jest jednym z najbardziej fascynujących enzymów poznanych przez współczesną biologię molekularną. Łączy w sobie zagadnienia starzenia komórkowego, nowotworzenia, stabilności genomu oraz medycyny regeneracyjnej. Zrozumienie jej budowy i działania pozwala wyjaśnić, dlaczego komórki mają ograniczoną liczbę podziałów, jak powstają komórki nowotworowe o potencjale nieograniczonego wzrostu oraz w jaki sposób można potencjalnie wydłużyć życie komórek bez wywoływania groźnych mutacji. Telomeraza stała się więc kluczem do badań nad granicami długowieczności oraz bezpieczeństwem manipulowania naszym **genomem**.
Budowa i funkcja telomerów – biologiczna osłona chromosomów
Telomery to wyspecjalizowane struktury znajdujące się na końcach chromosomów eukariotycznych. Składają się z wielokrotnie powtórzonych sekwencji DNA bogatych w guaninę, u człowieka najczęściej opisywanych jako powtórzenia TTAGGG. Te powtarzalne motywy tworzą swoisty bufor ochronny, który zabezpiecza materiał genetyczny przed utratą ważnych informacji podczas każdego cyklu replikacji. Zjawisko to jest konsekwencją problemu tzw. replikacji końców – polimerazy DNA nie są w stanie w pełni odtworzyć najdalszych fragmentów nici, co prowadzi do stopniowego skracania telomerów z każdym podziałem komórki.
Współpracujący z telomerami zestaw białek, określany jako kompleks „shelterin”, pełni kluczową rolę w utrzymaniu stabilności chromosomalnej. Białka te rozpoznają powtarzalne sekwencje DNA i tworzą strukturę przypominającą pętlę (T-loop), w której koniec chromosomu chowa się wewnątrz własnego regionu telomerowego. Zapobiega to błędnemu rozpoznaniu końca chromosomu jako przerwanego DNA przez systemy naprawcze komórki. Gdyby telomery nie istniały lub były zbyt krótkie, końce chromosomów mogłyby ulegać niekontrolowanym fuzjom, rearanżacjom i pęknięciom, co prowadziłoby do niestabilności genetycznej oraz zwiększonego ryzyka transformacji nowotworowej.
Długość telomerów jest zatem wskaźnikiem „wieku replikacyjnego” komórki. U noworodków telomery są relatywnie długie, natomiast u osób starszych ulegają znacznemu skróceniu. Gdy osiągną krytyczną długość, komórka wchodzi w stan senescencji replikacyjnej – przestaje się dzielić, choć może pozostawać metabolicznie czynna. To biologiczne ograniczenie, określane mianem limitu Hayflicka, wiąże się nierozerwalnie z pojęciem starzenia tkanek i całego organizmu. Telomery są więc wrażliwymi wskaźnikami kumulowanego stresu replikacyjnego, oksydacyjnego oraz działania różnych czynników środowiskowych, które przyspieszają degradację materiału genetycznego.
Środowisko komórkowe wpływa istotnie na tempo skracania telomerów. Reaktywne formy tlenu, przewlekły stan zapalny, niedobór antyoksydantów czy ekspozycja na toksyny środowiskowe powodują częstsze uszkodzenia DNA w regionach telomerowych. Mechanizmy naprawcze, choć rozbudowane, nie zawsze potrafią w pełni odtworzyć pierwotną strukturę końca chromosomu. W efekcie telomery skracają się szybciej, a komórki szybciej osiągają senescencję. Z drugiej strony, pewne typy komórek, jak komórki macierzyste, komórki rozrodcze czy niektóre populacje limfocytów, dysponują sposobem radzenia sobie z tym problemem – właśnie dzięki aktywności telomerazy.
Budowa i mechanizm działania telomerazy
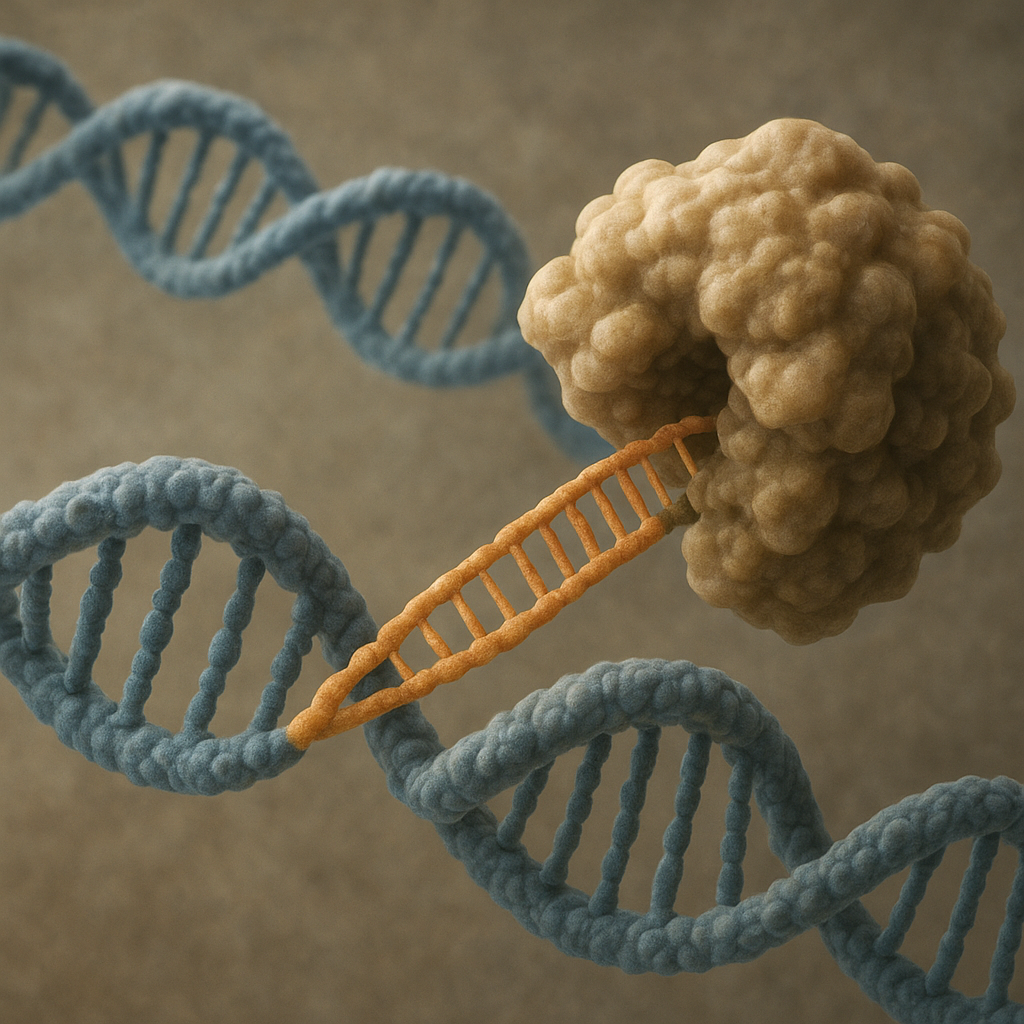
Telomeraza jest rybonukleoproteiną, co oznacza, że składa się zarówno z komponentu białkowego, jak i z cząsteczki RNA pełniącej rolę matrycy. Głównym elementem enzymatycznym jest odwrotna transkryptaza telomerazowa (TERT), natomiast komponent RNA (TERC) zawiera sekwencję komplementarną do motywów telomerowych. Dzięki temu telomeraza może wydłużać końce chromosomów, dobudowując kolejne powtórzenia sekwencji telomerowej na podstawie zakodowanego w sobie fragmentu RNA. Mechanizm ten jest przykładem odwrotnej transkrypcji, podobnej do działania odwrotnej transkryptazy wirusów retrowirusowych, lecz wyspecjalizowanej do modyfikacji końców chromosomów.
Działanie telomerazy można przedstawić jako cykliczny proces: najpierw kompleks telomeraza–DNA wiąże się z wolnym końcem 3′ nici G-bogatej telomeru, następnie enzym wykorzystuje swój RNA jako matrycę do wydłużenia nici DNA o kilka nukleotydów. Po zakończeniu tego etapu następuje translokacja kompleksu – przesunięcie wzdłuż nowo zsyntetyzowanego fragmentu – i powtórzenie całego cyklu. W rezultacie pojedyncza cząsteczka telomerazy może wielokrotnie wydłużyć telomer, przywracając lub zwiększając jego długość. Ten proces zachodzi głównie w fazie S cyklu komórkowego, gdy replikowany jest cały genom.
Aktywność telomerazy jest ściśle regulowana. W większości somatycznych komórek dorosłego organizmu ekspresja podjednostki TERT jest zredukowana do bardzo niskiego poziomu lub całkowicie wyciszona. Ma to znaczenie ochronne: brak telomerazy ogranicza liczbę podziałów komórki, co zmniejsza ryzyko akumulacji mutacji i powstania **nowotworów**. Jednak w specyficznych liniach komórkowych, zwłaszcza w komórkach macierzystych oraz w komórkach rozrodczych, wysoka aktywność telomerazy jest niezbędna do utrzymania zdolności do wielokrotnych podziałów i zapewnienia ciągłości gatunku. Utrzymanie równowagi między aktywnością a wyciszeniem telomerazy jest jednym z kluczowych wyzwań regulacji genomowej.
Istnieją również białka towarzyszące telomerazie, które stabilizują jej strukturę i ułatwiają rekrutację do telomerów. Należą do nich czynniki odpowiedzialne za dojrzewanie RNA telomerazowego, białka chaperonowe umożliwiające prawidłowe fałdowanie podjednostki TERT, a także liczne komponenty kompleksu shelterin modulujące dostęp enzymu do końca chromosomu. Ta złożona sieć interakcji zapewnia, że telomeraza działa w odpowiednim miejscu i czasie, a także że jej aktywność jest dopasowana do potrzeb konkretnego typu komórki. Zaburzenia w którymkolwiek z tych etapów mogą prowadzić do poważnych konsekwencji, od przedwczesnego starzenia się tkanek po rozwój chorób proliferacyjnych.
Struktura telomerazy, poznawana z użyciem krioelektronowej mikroskopii oraz krystalografii rentgenowskiej, ujawnia skomplikowaną organizację domen funkcjonalnych. Rdzeń TERT zawiera motywy charakterystyczne dla odwrotnych transkryptaz, w tym domenę palca, dłoni i kciuka, odpowiedzialne za wiązanie DNA i polimeryzację. Część RNA tworzy z kolei pętle i helisy, które precyzyjnie pozycjonują matrycę w centrum katalitycznym enzymu. Ta wyspecjalizowana architektura umożliwia wyjątkową dokładność dodawania prawidłowych nukleotydów, mimo że telomerowy DNA składa się z monotonnych powtórzeń. Zrozumienie tych detali strukturalnych jest fundamentem projektowania specyficznych inhibitorów telomerazy w terapii nowotworów oraz potencjalnych aktywatorów w medycynie regeneracyjnej.
Telomeraza a starzenie się organizmu
Starzenie na poziomie organizmu jest w dużej mierze odzwierciedleniem procesów zachodzących w poszczególnych komórkach. Wraz z upływem czasu komórki somatyczne ulegają licznym podziałom, a ich telomery systematycznie się skracają. Po osiągnięciu krytycznej długości aktywowane są ścieżki odpowiedzi na uszkodzenia DNA, z udziałem białek takich jak p53 czy p16INK4a. Komórka wchodzi w stan trwałej senescencji, przestając się dzielić. Z jednej strony chroni to przed niekontrolowanym wzrostem i powstaniem guza, z drugiej jednak prowadzi do stopniowego wyczerpywania się puli komórek zdolnych do regeneracji tkanek. Gromadzenie się komórek starzejących się przyczynia się do osłabienia funkcji narządów, przewlekłego stanu zapalnego i wielu cech fenotypowych starzenia.
Telomeraza jawi się tutaj jako potencjalne narzędzie spowolnienia tego procesu. Badania na modelach zwierzęcych pokazały, że zwiększenie aktywności telomerazy w wybranych tkankach może wydłużać życie komórek, poprawiać funkcję układów regeneracyjnych oraz opóźniać pojawienie się objawów starzenia. Szczególnie interesujące okazały się eksperymenty z wprowadzaniem genu TERT przy użyciu wektorów wirusowych lub metod edycji genów. W wielu przypadkach obserwowano poprawę wydolności hematopoetycznego układu krwiotwórczego, lepszą regenerację nabłonka jelitowego czy wzrost neurogenezy. Jednak każdorazowe podnoszenie aktywności telomerazy wiąże się z ryzykiem zwiększenia podatności na transformację nowotworową, co czyni tę strategię wyjątkowo delikatną.
Dane epidemiologiczne wskazują, że długość telomerów w leukocytach koreluje z niektórymi aspektami zdrowia i długowieczności. Osoby o krótszych telomerach częściej wykazują objawy chorób sercowo-naczyniowych, zespołów metabolicznych czy obniżonej odporności. Z kolei niektóre grupy stulatków charakteryzują się dłuższymi telomerami niż przeciętna populacja. Nie oznacza to jednak, że sama długość telomerów determinuje długość życia – jest raczej jednym z wielu biomarkerów złożonego procesu starzenia, w którym znaczącą rolę grają czynniki genetyczne, środowiskowe i styl życia, w tym dieta, aktywność fizyczna oraz narażenie na stres.
Badania interwencyjne sugerują, że zmiana stylu życia może wpływać na dynamikę zmian telomerowych. Programy obejmujące redukcję stresu, regularną aktywność fizyczną, dietę bogatą w substancje antyoksydacyjne oraz dobre wsparcie społeczne bywają powiązane z wolniejszym skracaniem telomerów, a w niektórych pracach nawet z nieznacznym ich wydłużeniem. Mechanizmy leżące u podstaw takich efektów nie są jeszcze w pełni poznane, lecz prawdopodobnie obejmują zmniejszenie obciążenia oksydacyjnego i zapalnego, a także korzystne oddziaływanie na regulację ekspresji TERT. Telomeraza pozostaje więc w centrum zainteresowania nie tylko biologów molekularnych, ale również badaczy zdrowia publicznego i medycyny stylu życia.
Interesującym aspektem jest także rola telomerazy w komórkach immunologicznych. Limfocyty T i B, które muszą wielokrotnie proliferować w odpowiedzi na zakażenia, wymagają okresowej aktywacji telomerazy, aby zachować zdolność do odpowiedzi immunologicznej przez całe życie. Z wiekiem efektywność tej aktywacji maleje, co może przyczyniać się do immunosenescencji, czyli starzenia się układu odpornościowego. Zrozumienie finezyjnej regulacji telomerazy w limfocytach może prowadzić do opracowania strategii poprawiających funkcję immunologiczną osób starszych, na przykład poprzez czasowe, ściśle kontrolowane podnoszenie aktywności enzymu.
Telomeraza w nowotworach – miecz obosieczny
Jednym z najbardziej paradoksalnych aspektów biologii telomerazy jest jej rola w nowotworzeniu. Podczas gdy w komórkach somatycznych wyciszenie telomerazy ogranicza liczbę podziałów, w komórkach nowotworowych dochodzi często do ponownej aktywacji enzymu. Szacuje się, że w ponad 80–90% ludzkich nowotworów obserwuje się podwyższoną aktywność telomerazy, co umożliwia komórkom rakowym przełamanie bariery senescencji i osiągnięcie potencjalnej nieśmiertelności replikacyjnej. W wielu przypadkach aktywacja ta wynika z mutacji w promotorze genu TERT, amplifikacji kopii genu lub zaburzeń w szlakach regulacyjnych kontrolujących jego ekspresję.
W początkowych etapach transformacji nowotworowej telomery komórek ulegają często znacznemu skróceniu, co zwiększa niestabilność genomu i sprzyja akumulacji kolejnych mutacji. Dopiero późniejsza reekspresja telomerazy stabilizuje długość telomerów na pewnym poziomie, umożliwiając utrzymanie złośliwego klonu. To właśnie połączenie wczesnej niestabilności chromosomowej z późniejszą aktywacją telomerazy uważa się za jeden z kluczowych kroków umożliwiających nowotworom rozwój i przerzuty. Telomeraza staje się tym samym atrakcyjnym celem terapeutycznym, ponieważ jest dużo bardziej aktywna w komórkach nowotworowych niż w większości zdrowych tkanek dorosłego organizmu.
Opracowano liczne strategie hamowania telomerazy w nowotworach. Jednym podejściem są małe cząsteczki inhibitorów, które wiążą się z centrum katalitycznym TERT i blokują jego zdolność do wydłużania telomerów. Innym sposobem jest stosowanie oligonukleotydów antysensownych lub mimetyków RNA, które wiążą się z komponentem TERC i zaburzają jego funkcję matrycową. Badano także szczepionki terapeutyczne skierowane przeciwko białku TERT, mające za zadanie wywołać odpowiedź immunologiczną organizmu przeciwko komórkom nowotworowym wykazującym wysoką ekspresję tego antygenu. Każda z tych strategii niesie ze sobą wyzwania dotyczące skuteczności, specyficzności oraz potencjalnych działań niepożądanych.
Jednym z problemów terapii antytelomerazowych jest czas potrzebny na osiągnięcie efektu. Ponieważ hamowanie telomerazy nie skraca telomerów natychmiast, lecz jedynie uniemożliwia ich dalsze wydłużanie, komórki z już względnie długimi telomerami mogą dalej dzielić się przez wiele cykli przed osiągnięciem krytycznej długości. Z tego powodu inhibitory telomerazy mogą okazać się najbardziej użyteczne w leczeniu nowotworów o stosunkowo krótkich telomerach lub w połączeniu z innymi terapiami uszkadzającymi DNA. Dodatkowo część guzów wykorzystuje alternatywne mechanizmy wydłużania telomerów (ALT), oparte na rekombinacji homologicznej, co czyni je opornymi na klasyczne strategie ukierunkowane na telomerazę.
Równocześnie należy pamiętać, że całkowite wyeliminowanie aktywności telomerazy w organizmie mogłoby mieć poważne konsekwencje dla tkanek o wysokim potencjale regeneracyjnym, takich jak szpik kostny czy nabłonek jelit. Dlatego nowoczesne podejścia terapeutyczne koncentrują się na precyzyjnym kierowaniu inhibitorów do komórek nowotworowych oraz na wykorzystaniu różnic w regulacji ekspresji TERT między komórkami prawidłowymi a złośliwymi. Coraz istotniejszą rolę odgrywają tutaj systemy dostarczania leków, nanopartykule, przeciwciała monoklonalne oraz strategie łączące inhibitory telomerazy z tradycyjną chemioterapią, radioterapią czy nowymi lekami celowanymi.
Telomeraza w medycynie regeneracyjnej i terapii genowej
Poza onkologią jednym z najciekawszych obszarów badań nad telomerazą jest medycyna regeneracyjna. Komórki macierzyste, zarówno embrionalne, jak i indukowane pluripotencjalne (iPSC), wykazują wysoką aktywność telomerazy, która umożliwia im wielokrotne podziały bez istotnego skracania telomerów. Jest to warunek konieczny do tworzenia stabilnych linii komórkowych zdolnych do różnicowania się w różne typy tkanek. Zbyt krótkie telomery w komórkach macierzystych ograniczałyby ich użyteczność terapeutyczną, prowadząc do szybkiego wyczerpania potencjału proliferacyjnego po przeszczepieniu pacjentowi.
W terapii genowej rozważane jest czasowe zwiększenie aktywności telomerazy w określonych tkankach dotkniętych chorobami degeneracyjnymi. Przykładem mogą być dziedziczne zespoły związane z mutacjami w genach kodujących komponenty telomerazy lub białka telomerowe, takie jak dyskeratoza wrodzona, idiopatyczne włóknienie płuc czy część aplastycznych niedokrwistości. W tych schorzeniach skrócone telomery prowadzą do przedwczesnego wyczerpania puli komórek progenitorowych w szpiku kostnym, płucach czy skórze. Dostarczenie prawidłowych kopii genów TERT lub TERC, albo farmakologiczne pobudzenie aktywności endogennej telomerazy, mogłoby teoretycznie przywrócić zdolność tkanek do regeneracji.
Istotne są jednak kwestie bezpieczeństwa. Każda interwencja zwiększająca aktywność telomerazy niesie ryzyko stymulacji już istniejących, ale dotąd uśpionych komórek przednowotworowych. Z tego względu badacze starają się opracować systemy regulowane, w których gen telomerazy aktywowany jest jedynie przejściowo lub tylko w ściśle określonych populacjach komórek. Rozwijane są konstrukty genowe kontrolowane przez indukowane promotory, a także wektory wirusowe, które preferencyjnie infekują wybrane typy komórkowe. Celem jest osiągnięcie takiego poziomu aktywności telomerazy, który wystarczy do poprawy regeneracji, lecz nie przekroczy progu sprzyjającego niekontrolowanej proliferacji.
Ciekawym kierunkiem są również małe cząsteczki i peptydy zdolne do modulowania aktywności telomerazy na poziomie posttranslacyjnym. Niektóre z nich wpływają na stabilność TERT, jego lokalizację jądrową lub interakcje z kompleksami białkowymi przy telomerach. Inne oddziałują na szlaki sygnałowe kontrolujące ekspresję genu TERT, takie jak szlak Wnt/β-katenina, MYC czy szlaki związane z czynnikami wzrostu. Precyzyjne zrozumienie tych mechanizmów otwiera drogę do projektowania leków, które będą w stanie subtelnie zwiększać aktywność telomerazy w komórkach wymagających wsparcia regeneracyjnego, bez globalnego podnoszenia jej poziomu w całym organizmie.
W kontekście inżynierii tkanek telomeraza pomaga rozwiązać problem ograniczonej liczby podziałów komórek używanych do tworzenia sztucznych narządów i przeszczepów. Na przykład fibroblasty, chondrocyty czy komórki śródbłonka hodowane in vitro, po pewnym czasie przestają się dzielić właśnie z powodu skracania telomerów. Wprowadzenie genu TERT może znacząco wydłużyć ich żywotność, umożliwiając wytworzenie większej ilości materiału biologicznego do przeszczepu. Jednocześnie konieczne jest zachowanie ścisłej kontroli nad stabilnością genomową i brakiem cech transformacji nowotworowej takich „wydłużonych” linii komórkowych, co wymaga zaawansowanego monitoringu genetycznego.
Kontrowersje, ograniczenia i przyszłe kierunki badań
Mimo ogromnego postępu w badaniach nad telomerazą istnieje wiele kontrowersji i otwartych pytań. Jednym z nich jest rzeczywista użyteczność długości telomerów jako uniwersalnego biomarkera starzenia. Wyniki badań populacyjnych bywają niespójne, a na długość telomerów wpływa ogromna liczba czynników zmiennych – od wrodzonych różnic genetycznych po wpływ środowiska i metodologii pomiaru. Co więcej, różne tkanki tego samego organizmu mogą wykazywać odmienne tempo zmian telomerowych, co utrudnia wyciąganie prostych wniosków na podstawie pojedynczego pomiaru, najczęściej dokonywanego w krwi obwodowej.
Kolejną kwestią jest próba „celowego wydłużania życia” poprzez manipulację telomerazą. Choć dane z modeli zwierzęcych są zachęcające, przeniesienie takich interwencji na ludzi wiąże się z dużą niepewnością. Ryzyko nowotworzenia jest tutaj centralnym problemem. Wiele organizmów długowiecznych, takich jak niektóre gatunki nietoperzy czy nagie szczury piaskowe, zachowuje wyjątkowo stabilne telomery i niską częstość nowotworów, co sugeruje istnienie dodatkowych mechanizmów ochronnych. U człowieka takie równoważące mechanizmy mogą nie być wystarczająco silne, aby bezpiecznie tolerować długotrwałe, podwyższone poziomy aktywności telomerazy.
Przyszłe badania koncentrują się również na lepszym zrozumieniu alternatywnych ścieżek wydłużania telomerów, zwłaszcza mechanizmu ALT obserwowanego w części nowotworów. W tych guzach brak aktywnej telomerazy nie oznacza braku zdolności do utrzymania długości telomerów – zamiast tego wykorzystywane są procesy rekombinacji, które kopiują sekwencje telomerowe z jednego chromosomu na drugi. Zrozumienie, jak komórki przełączają się między użyciem telomerazy a ALT, może dostarczyć nowych możliwości terapeutycznych, szczególnie w nowotworach opornych na klasyczne inhibitory telomerazy.
Wreszcie, wyzwaniem pozostaje opracowanie standaryzowanych metod pomiaru długości telomerów i aktywności telomerazy w materiałach klinicznych. Obecnie stosuje się różne techniki, od klasycznych metod Southern blot (TRF), przez qPCR, po bardziej zaawansowane metody pojedynczo-komórkowe i sekwencjonowanie następnej generacji. Każda z nich ma inne ograniczenia i czułość, co utrudnia porównywanie wyników między badaniami. Ustanowienie spójnych protokołów oraz referencyjnych materiałów kontrolnych jest warunkiem wykorzystania parametrów telomerowych w rutynowej praktyce diagnostycznej i monitorowaniu terapii celowanych na telomerazę.
Najczęściej zadawane pytania (FAQ)
Czym dokładnie jest telomeraza i w jakich komórkach występuje?
Telomeraza to enzym o aktywności odwrotnej transkryptazy, który wydłuża telomery na końcach chromosomów, dobudowując powtarzalne sekwencje DNA na podstawie własnej matrycy RNA. Dzięki temu kompensuje utratę materiału genetycznego zachodzącą przy każdym podziale komórki. Wysoka aktywność telomerazy występuje głównie w komórkach rozrodczych, komórkach macierzystych oraz większości komórek nowotworowych, natomiast w typowych komórkach somatycznych dorosłego człowieka jest ona bardzo niska lub niewykrywalna.
Jak telomeraza wpływa na proces starzenia się organizmu?
Starzenie komórkowe wiąże się ze skracaniem telomerów podczas kolejnych podziałów. Gdy telomery osiągną krytyczną długość, komórka przestaje się dzielić i wchodzi w stan senescencji. Telomeraza, poprzez wydłużanie telomerów, może opóźniać nadejście tego etapu, co teoretycznie spowalnia starzenie tkanek. Jednak zbyt wysoka lub niekontrolowana aktywność enzymu zwiększa ryzyko transformacji nowotworowej. Dlatego w organizmach wielokomórkowych, takich jak człowiek, jej działanie jest celowo ograniczane w większości komórek somatycznych, co stanowi kompromis między długowiecznością a bezpieczeństwem przeciwnowotworowym.
Dlaczego telomeraza jest celem w terapii przeciwnowotworowej?
Większość nowotworów wykorzystuje telomerazę, aby utrzymać telomery na wystarczającej długości i dzielić się praktycznie bez ograniczeń. Blokując aktywność tego enzymu, można doprowadzić do dalszego skracania telomerów w komórkach nowotworowych, aż osiągną one punkt, w którym przestają się dzielić lub ulegają śmierci. Ponieważ telomeraza jest zwykle dużo bardziej aktywna w komórkach rakowych niż w zdrowych tkankach dorosłego człowieka, stanowi atrakcyjny cel leków celowanych. Wciąż jednak trwają prace nad zwiększeniem skuteczności i bezpieczeństwa takich terapii, a także nad połączeniem ich z innymi formami leczenia onkologicznego.
Czy można „wydłużyć życie” poprzez sztuczną aktywację telomerazy?
Eksperymenty na modelach zwierzęcych pokazują, że podniesienie aktywności telomerazy w niektórych tkankach może poprawiać regenerację i opóźniać objawy starzenia. Nie oznacza to jednak prostego przedłużenia życia całego organizmu. Największym zagrożeniem jest wzrost ryzyka nowotworów, ponieważ komórki z wydłużonymi telomerami i aktywną telomerazą łatwiej przełamują bariery ograniczające ich podziały. U ludzi wciąż nie ma bezpiecznej, zatwierdzonej klinicznie metody trwałej aktywacji telomerazy w celu przedłużenia życia. Badania skupiają się raczej na wykorzystaniu tego enzymu w leczeniu konkretnych chorób związanych z przedwczesnym skracaniem telomerów.
Jak styl życia wpływa na telomery i aktywność telomerazy?
Na tempo skracania telomerów oddziałują czynniki środowiskowe i behawioralne, takie jak przewlekły stres, palenie tytoniu, otyłość, brak ruchu czy dieta uboga w antyoksydanty. Sprzyjają one wzrostowi obciążenia oksydacyjnego i zapalnego, co przyspiesza uszkadzanie DNA w rejonach telomerowych. Badania sugerują, że zdrowy styl życia – obejmujący zbilansowaną dietę, regularny wysiłek fizyczny, kontrolę stresu i dobre relacje społeczne – może spowalniać skracanie telomerów, a niekiedy nawet wiązać się z ich umiarkowanym wydłużaniem. Mechanizmy te są złożone i obejmują zarówno wpływ na stres oksydacyjny, jak i na regulację ekspresji genów związanych z telomerazą.