Tkanka nerwowa jest jednym z najbardziej wyspecjalizowanych i fascynujących rodzajów tkanek w świecie organizmów zwierzęcych. To dzięki niej możliwe jest odbieranie bodźców z otoczenia, ich analiza, a następnie koordynacja reakcji całego organizmu – od szybkiego cofnięcia ręki od gorącego przedmiotu, aż po tworzenie abstrakcyjnych pojęć i złożonych wspomnień. Zrozumienie budowy i funkcji tkanki nerwowej stanowi fundament nowoczesnej neurobiologii, medycyny oraz nauk kognitywnych, a jednocześnie otwiera drogę do poznawania mechanizmów świadomości i procesu uczenia się.
Podstawowa charakterystyka i rodzaje komórek tkanki nerwowej
Tkanka nerwowa jest wyspecjalizowana w odbieraniu, przewodzeniu i przetwarzaniu sygnałów. Tworzy mózg, rdzeń kręgowy oraz nerwy obwodowe, a więc centralny i obwodowy układ nerwowy. Jej wyjątkowość wynika z obecności wyspecjalizowanych komórek – neuronów i komórek glejowych – które współpracują, tworząc gigantyczną, niezwykle dynamiczną sieć komunikacyjną. Ta sieć pozwala organizmowi reagować w ułamkach sekund na zmiany środowiska oraz regulować procesy zachodzące wewnątrz ciała.
Neurony – komórki przewodzące impulsy
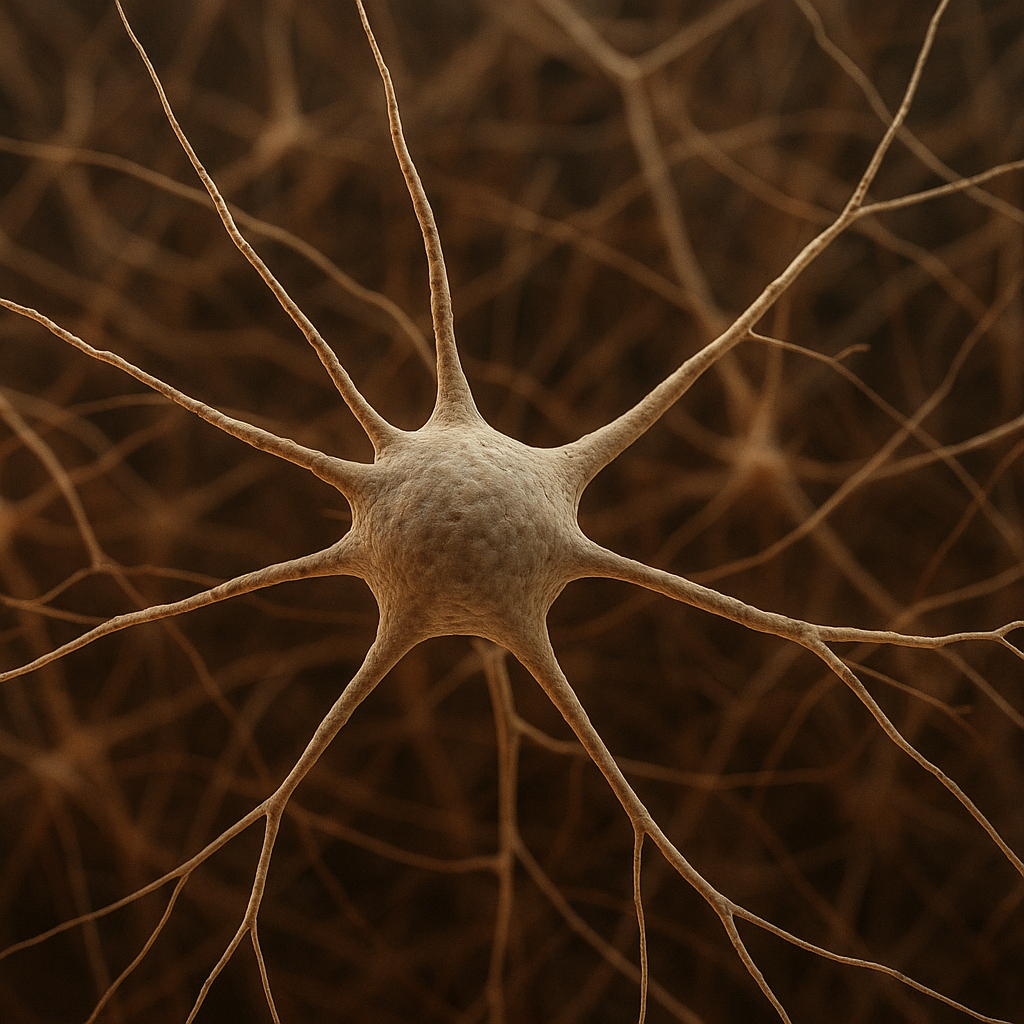
Neurony to podstawowe, funkcjonalne jednostki tkanki nerwowej. Są przystosowane do generowania i przewodzenia sygnałów elektrycznych – potencjałów czynnościowych. Każdy neuron, niezależnie od kształtu i umiejscowienia, posiada trzy zasadnicze części: ciało komórki (perykarion lub soma), dendryty oraz akson. To właśnie dzięki tej trójdzielnej organizacji neurony mogą odbierać informacje, integrować je i przekazywać dalej.
Ciało komórki zawiera jądro oraz większość organelli odpowiedzialnych za metabolizm i syntezę białek. W neuronach występują liczne rybosomy i rozbudowana siateczka śródplazmatyczna, tworząca tzw. tigroid (substancję Nissla). Tigroid odpowiada za intensywną syntezę białek, niezbędnych do utrzymania rozległych wypustek komórkowych. Utrata lub uszkodzenie ciała komórki zwykle prowadzi do śmierci neuronu, ponieważ nie jest on w stanie odbudować swoich struktur.
Dendryty to krótsze, często silnie rozgałęzione wypustki, wyspecjalizowane w odbieraniu informacji z innych neuronów lub receptorów czuciowych. Ułatwiają to liczne kolce dendrytyczne – niewielkie uwypuklenia, w których zlokalizowane są synapsy. To na dendrytach koncentruje się znaczna część sygnałów pobudzających i hamujących, decydujących o tym, czy neuron wygeneruje potencjał czynnościowy.
Akson jest zwykle pojedynczą, długą wypustką odpowiedzialną za przewodzenie impulsu z ciała neuronu do kolejnych komórek. U wielu neuronów akson jest otoczony osłonką mielinową wytwarzaną przez wyspecjalizowane komórki glejowe. Dzięki mielinie przewodzenie impulsów jest szybsze i bardziej ekonomiczne energetycznie. Miejsca przerwy w osłonce, zwane przewężeniami Ranviera, umożliwiają tzw. skokowe przewodzenie pobudzenia.
Na końcu aksonu znajduje się rozgałęzienie zwane drzewkiem końcowym, zakończone licznymi zakończeniami synaptycznymi. W nich zlokalizowane są pęcherzyki wypełnione neuroprzekaźnikami, które po pobudzeniu neuronu są uwalniane do szczeliny synaptycznej i oddziałują na kolejny neuron, włókno mięśniowe lub komórkę gruczołową.
Komórki glejowe – cicha większość układu nerwowego
Choć neurony są najbardziej spektakularnymi komórkami układu nerwowego, liczebnie ustępują komórkom glejowym. Komórki glejowe pełnią funkcje podporowe, odżywcze, ochronne i regulacyjne. W przeszłości uważano je za bierną „izolację” dla neuronów, dziś wiadomo, że aktywnie uczestniczą w przetwarzaniu informacji.
W ośrodkowym układzie nerwowym najważniejsze typy gleju to astrocyty, oligodendrocyty, komórki mikrogleju oraz ependymocyty. Astrocyty tworzą barierę krew–mózg, regulują skład jonowy otoczenia neuronów, wychwytują nadmiar neuroprzekaźników i wydzielają substancje troficzne, wspierające przeżycie komórek nerwowych. Oligodendrocyty wytwarzają mielinę wokół aksonów w mózgu i rdzeniu kręgowym, natomiast mikroglej pełni funkcję „układu odpornościowego” w mózgu – usuwa obumarłe komórki i reaguje na uszkodzenia.
W obwodowym układzie nerwowym funkcję tworzenia osłonek mielinowych pełnią komórki Schwanna. Każda z nich obejmuje fragment jednego aksonu, nawijając wokół niego wiele warstw swojej błony komórkowej. To właśnie naprzemienny układ segmentów mielinowych i przewężeń Ranviera warunkuje szybkie przewodzenie impulsów w nerwach obwodowych.
Różnorodność morfologiczna i funkcjonalna neuronów
Neurony można klasyfikować na wiele sposobów: według liczby wypustek (neurony wielobiegunowe, dwubiegunowe i pseudojednobiegunowe), według funkcji (czuciowe, ruchowe, pośredniczące), a także na podstawie neuroprzekaźników, jakich używają (np. glutaminergiczne, GABA-ergiczne, dopaminergiczne). Ta ogromna różnorodność odzwierciedla złożone zadania, jakie pełni tkanka nerwowa w organizmach – od prostych odruchów po złożone procesy myślowe.
Przykładowo, neurony ruchowe rdzenia kręgowego posiadają długie aksony sięgające aż do mięśni, natomiast interneurony w obrębie kory mózgu mogą mieć rozbudowaną sieć lokalnych połączeń, które modulują aktywność sąsiednich komórek. Istnieją także wyspecjalizowane neurony projekcyjne, łączące odległe obszary mózgu, jak np. neurony piramidowe kory mózgowej czy komórki Purkinjego w móżdżku.
Jak działa tkanka nerwowa: impulsy, synapsy i sieci
Funkcjonowanie tkanki nerwowej opiera się na precyzyjnym oraz dynamicznym przetwarzaniu informacji. Podstawą tego procesu są zjawiska bioelektryczne i biochemiczne zachodzące na błonie komórkowej neuronów oraz w przestrzeni synaptycznej. Choć impuls nerwowy trwa zaledwie milisekundy, jego powstanie i przekazanie wymaga istnienia skomplikowanych gradientów jonowych, kanałów błonowych i mechanizmów sprzężenia zwrotnego.
Potencjał spoczynkowy i warunki pobudliwości neuronu
Błona neuronu w stanie spoczynku utrzymuje różnicę ładunków elektrycznych między wnętrzem a otoczeniem komórki. Wnętrze neuronu jest naładowane ujemnie względem środowiska zewnętrznego głównie dzięki różnicom w stężeniach jonów sodu, potasu, chlorkowych oraz anionów białczanowych. Ta różnica potencjałów, zwykle ok. –70 mV, nazywana jest potencjałem spoczynkowym.
Utrzymanie potencjału spoczynkowego wymaga działania pompy sodowo-potasowej, która z wykorzystaniem energii z ATP usuwa jony sodu na zewnątrz i wprowadza jony potasu do wnętrza. Ponadto selektywna przepuszczalność błony dla jonów potasu i obecność kanałów przeciekowych decydują o rozkładzie jonowym. Neuron pozostaje gotowy do szybkiej reakcji – wystarczy, że suma napływających bodźców osiągnie określony próg, aby uruchomił się potencjał czynnościowy.
Potencjał czynnościowy i przewodzenie impulsu
Potencjał czynnościowy jest gwałtowną, krótkotrwałą zmianą potencjału błonowego neuronu. Po osiągnięciu progu pobudzenia otwierają się kanały sodowe bramkowane napięciem, co umożliwia szybki napływ jonów sodu do wnętrza komórki. Błona ulega depolaryzacji – jej potencjał przechodzi z wartości ujemnych do dodatnich. Następnie otwierają się kanały potasowe, przez które jony potasu wypływają na zewnątrz, przywracając stan zbliżony do spoczynkowego, czyli repolaryzację.
Proces ten rozprzestrzenia się wzdłuż aksonu, ponieważ lokalna depolaryzacja pobudza sąsiednie odcinki błony. W aksonach niezmielinizowanych depolaryzacja postępuje punkt po punkcie, stosunkowo wolno. Natomiast w aksonach pokrytych osłonką mielinową impuls „przeskakuje” między przewężeniami Ranviera, co znacznie przyspiesza transmisję. Tzw. przewodzenie skokowe jest bardziej energooszczędne, gdyż wymaga mniejszej liczby pomp jonowych do przywracania potencjału spoczynkowego.
Ważnym elementem jest okres refrakcji, czyli czas, w którym dany fragment błony nie może zostać ponownie pobudzony lub wymaga silniejszego bodźca. Gwarantuje to jednokierunkowe przewodzenie impulsu od ciała neuronu w stronę synapsy i zapobiega chaotycznemu rozchodzeniu się pobudzeń.
Synapsy chemiczne i elektryczne
Neurony komunikują się ze sobą na styku zwanym synapsą. W większości przypadków są to synapsy chemiczne. Zakończenie aksonu (błona presynaptyczna) znajduje się bardzo blisko błony kolejnej komórki (błona postsynaptyczna), ale nie styka się z nią bezpośrednio – między nimi istnieje szczelina synaptyczna. Gdy potencjał czynnościowy dociera do zakończenia aksonu, dochodzi do otwarcia kanałów wapniowych i napływu jonów wapnia do wnętrza zakończenia synaptycznego.
Podwyższone stężenie wapnia inicjuje zjawisko egzocytozy: pęcherzyki z neuroprzekaźnikiem łączą się z błoną presynaptyczną i uwalniają zawartość do szczeliny. Neuroprzekaźnik dyfunduje, wiąże się z receptorami po stronie postsynaptycznej i wywołuje określoną odpowiedź – pobudzającą lub hamującą. Charakter odpowiedzi zależy od rodzaju receptora i samego neuroprzekaźnika.
Synapsy pobudzające zwykle depolaryzują błonę postsynaptyczną, przybliżając ją do progu pobudzenia. Przykładowo, glutaminian jest głównym neuroprzekaźnikiem pobudzającym w ośrodkowym układzie nerwowym kręgowców. Synapsy hamujące wywołują hiperpolaryzację, oddalając potencjał błonowy od progu; typowym mediatorem hamującym jest GABA lub glicyna. Dzięki równowadze bodźców pobudzających i hamujących aktywność sieci neuronalnych pozostaje stabilna i kontrolowana.
Synapsy elektryczne są rzadsze u ssaków. Polegają na bezpośrednim połączeniu cytoplazmy dwóch sąsiadujących komórek za pomocą tzw. koneksonów, tworzących połączenia szczelinowe. Umożliwiają bardzo szybkie, niemal jednoczesne przenoszenie zmian potencjału, co jest szczególnie ważne w sieciach wymagających wysokiej synchronizacji, np. w niektórych strukturach mózgu i mięśniu sercowym u innych grup zwierząt.
Neuroprzekaźniki i modulacja synaptyczna
Neuroprzekaźniki (neurotransmitery) są związkami chemicznymi umożliwiającymi komunikację między neuronami. Można je podzielić na kilka grup: aminokwasy (glutaminian, GABA, glicyna), aminy biogenne (dopamina, serotonina, noradrenalina, acetylocholina), neuropeptydy (substancja P, endorfiny) oraz inne związki, jak np. ATP czy tlenek azotu.
Niektóre z nich wywołują szybkie, krótkotrwałe efekty postsynaptyczne, inne działają wolniej, regulując ogólną pobudliwość neuronów i modulując siłę połączeń synaptycznych. Przykładowo dopamina odgrywa kluczową rolę w układach nagrody i motywacji, a jej zaburzenia są związane z chorobą Parkinsona oraz uzależnieniami. Serotonina wpływa na nastrój, sen, apetyt, a jej nieprawidłowy poziom wiąże się z depresją i zaburzeniami lękowymi.
Modulacja synaptyczna oznacza, że siła przekazywania sygnału może ulegać zmianom w odpowiedzi na aktywność. Długotrwałe wzmocnienie synaptyczne (LTP) i długotrwałe osłabienie (LTD) to zjawiska uważane za podstawę procesów pamięci i uczenia się. Gdy synapsa jest wielokrotnie aktywowana w określony sposób, zwiększa się liczba receptorów postsynaptycznych lub ilość uwalnianego neuroprzekaźnika, co prowadzi do silniejszej odpowiedzi na kolejne bodźce.
Sieci neuronalne, obwody i plastyczność
Poszczególne neurony rzadko działają w izolacji – tworzą rozległe sieci, w których informacje są rozdzielane, integrowane i przetwarzane na wielu poziomach. W odruchach rdzeniowych, takich jak odruch kolanowy, wyróżnić można prosty łuk odruchowy: neuron czuciowy, interneuron oraz neuron ruchowy. W bardziej złożonych funkcjach, jak myślenie, mowa czy rozpoznawanie twarzy, zaangażowanych jest wiele obszarów mózgu, połączonych skomplikowanymi obwodami projekcyjnymi i asocjacyjnymi.
Jedną z najbardziej niezwykłych cech tkanki nerwowej jest plastyczność – zdolność do zmiany struktury i funkcji pod wpływem doświadczenia. Plastyczność obejmuje zarówno modyfikacje siły istniejących synaps, jak i powstawanie nowych połączeń lub eliminację nieużywanych. Dzięki temu układ nerwowy może adaptować się do nowych warunków, kompensować uszkodzenia i optymalizować działanie w zależności od wymagań środowiska.
Na poziomie rozwojowym plastyczność przejawia się w tzw. okresach krytycznych, kiedy doświadczenia mają szczególnie silny wpływ na kształtowanie połączeń neuronalnych. Klasycznym przykładem są badania nad widzeniem u ssaków, pokazujące, że brak bodźców wzrokowych w wczesnym okresie życia prowadzi do nieodwracalnych deficytów w korze wzrokowej.
Rola tkanki nerwowej w organizmie, rozwój i znaczenie kliniczne
Tkanka nerwowa odpowiada nie tylko za szybkie reakcje i integrację bodźców, ale też za działanie narządów wewnętrznych, procesy homeostatyczne, emocje, świadomość oraz tożsamość jednostki. Jej funkcje można rozpatrywać w perspektywie całego układu nerwowego – zarówno centralnego, jak i obwodowego – oraz ich wzajemnych powiązań z innymi układami organizmu.
Centralny i obwodowy układ nerwowy – organizacja funkcjonalna
Centralny układ nerwowy (OUN) obejmuje mózg i rdzeń kręgowy. Mózg odpowiada za przetwarzanie i integrację większości bodźców, planowanie ruchów, regulację emocji i funkcji poznawczych. Kora mózgowa, zbudowana z istoty szarej, jest miejscem powstawania złożonych reprezentacji informacji, uczuć oraz procesów decyzyjnych. Struktury podkorowe, takie jak jądra podstawne, wzgórze, podwzgórze czy hipokamp, pełnią wyspecjalizowane role w regulacji ruchu, przekazywaniu sygnałów, kontroli hormonów i konsolidacji pamięci.
Rdzeń kręgowy stanowi główną drogę przewodzenia impulsów między mózgiem a resztą ciała. Pełni również funkcje integracyjne w prostych odruchach, które nie wymagają udziału wyższych pięter OUN. W obrębie rdzenia znajdują się istota szara (ciała neuronów) i istota biała (aksony w osłonkach mielinowych), których ułożenie zapewnia sprawne przewodzenie sygnałów w górę i w dół osi ciała.
Obwodowy układ nerwowy (OUN w znaczeniu szerokim obejmuje całość, jednak skrót PNS dotyczy części obwodowej) tworzą nerwy czaszkowe i rdzeniowe oraz zwoje nerwowe. Zawiera on włókna czuciowe, doprowadzające informacje z receptorów do OUN, oraz włókna ruchowe, odprowadzające sygnały wykonawcze do mięśni i gruczołów. W ramach PNS wyróżniamy część somatyczną (kontrolującą ruchy dowolne i czucie świadome) oraz autonomiczną, związaną z regulacją narządów wewnętrznych.
Układ autonomiczny i neuroendokrynny
Układ autonomiczny (wegetatywny) działa niezależnie od woli i reguluje pracę serca, mięśniówki gładkiej naczyń i trzewi, gruczołów potowych, przewodu pokarmowego oraz innych narządów. Dzieli się on na część współczulną (sympatyczną) i przywspółczulną (parasympatyczną), które zazwyczaj działają antagonistycznie, zapewniając równowagę fizjologiczną.
Układ współczulny aktywowany jest w sytuacjach zagrożenia lub mobilizacji – przyspiesza akcję serca, rozszerza oskrzela, hamuje trawienie, kieruje krew do mięśni szkieletowych. Układ przywspółczulny sprzyja odpoczynkowi, trawieniu i regeneracji – zwalnia pracę serca, pobudza perystaltykę jelit, nasila wydzielanie śliny i soków trawiennych. Za przekazywanie informacji w tych obwodach odpowiadają specyficzne neuroprzekaźniki, głównie acetylocholina i noradrenalina.
Istotnym aspektem jest ścisłe powiązanie układu nerwowego z układem hormonalnym – tzw. układ neuroendokrynny. Podwzgórze i przysadka łączą sygnały nerwowe z wydzielaniem hormonów, regulując m.in. gospodarkę wodno-elektrolitową, temperaturę ciała, stres, łaknienie, dojrzewanie płciowe. Takie sprzężenie pozwala na zintegrowane sterowanie procesami długoterminowymi i krótkotrwałymi odpowiedziami organizmu.
Rozwój tkanki nerwowej i neurogeneza
Rozwój tkanki nerwowej rozpoczyna się bardzo wcześnie w życiu zarodkowym. Z ektodermy, jednego z trzech listków zarodkowych, powstaje płytka nerwowa, która następnie zagina się, tworząc cewę nerwową. Z cewy rozwija się mózg i rdzeń kręgowy, natomiast z grzebieni nerwowych – struktury obwodowe, w tym zwoje czuciowe i autonomiczne.
W trakcie rozwoju neurony powstają, migrują do docelowych obszarów, różnicują się oraz nawiązują połączenia. Tylko część z nich przetrwa – neurony wymagają sygnałów troficznych od komórek docelowych, a brak takich sygnałów prowadzi do zaprogramowanej śmierci komórki (apoptozy). Ten „nadmiarowy” rozwój, a następnie selekcja, zapewnia optymalne ukształtowanie sieci neuronalnych.
Przez długi czas uważano, że po zakończeniu rozwoju osobniczego neurony nie powstają już wcale. Obecnie wiadomo, że u ssaków, w tym u człowieka, zachodzi ograniczona neurogeneza w niektórych regionach mózgu, takich jak zakręt zębaty hipokampa czy opuszka węchowa (u części gatunków). Nowo powstałe neurony mogą wbudowywać się w istniejące sieci i uczestniczyć w procesach pamięci oraz adaptacji do nowych warunków.
Starzenie się i uszkodzenia tkanki nerwowej
Wraz z wiekiem w tkance nerwowej zachodzą zmiany związane z nagromadzeniem uszkodzeń komórkowych, stresem oksydacyjnym, stanem zapalnym oraz mniejszą wydolnością mechanizmów naprawczych. Część neuronów ulega stopniowej degeneracji, szczególnie w obszarach odpowiedzialnych za pamięć i funkcje wykonawcze. W niektórych przypadkach prowadzi to do patologii, takich jak choroba Alzheimera, Parkinsona czy innego typu otępienia.
Uszkodzenia mechaniczne, niedokrwienne lub toksyczne tkanki nerwowej często mają poważne konsekwencje, ponieważ neurony w ośrodkowym układzie nerwowym wykazują bardzo ograniczoną zdolność do regeneracji. W odróżnieniu od nerwów obwodowych, gdzie możliwa jest częściowa regeneracja aksonów przy udziale komórek Schwanna, w mózgu i rdzeniu kręgowym bariery biochemiczne i obecność inhibitorów wzrostu nerwów utrudniają odtwarzanie połączeń.
Współczesne badania starają się zrozumieć, jak stymulować plastyczność i regenerację tkanki nerwowej. Rozważa się m.in. wykorzystanie komórek macierzystych, czynników neurotroficznych, biomateriałów oraz interwencji farmakologicznych i fizjoterapeutycznych. Terapie te mają na celu poprawę funkcjonowania po udarach, urazach rdzenia kręgowego czy w przebiegu chorób neurodegeneracyjnych.
Zaburzenia funkcji i znaczenie kliniczne tkanki nerwowej
Ze względu na centralną rolę, jaką tkanka nerwowa odgrywa w organizmie, jej dysfunkcja przekłada się na szerokie spektrum chorób neurologicznych i psychiatrycznych. Udar mózgu, będący skutkiem zaburzeń ukrwienia, prowadzi do ogniskowego obumarcia neuronów, co często skutkuje niedowładem, zaburzeniami mowy, widzenia lub pamięci. Stwardnienie rozsiane wiąże się z uszkodzeniem osłonek mielinowych w OUN, co upośledza przewodzenie impulsów i powoduje objawy ruchowe oraz czuciowe.
Choroby neurodegeneracyjne, takie jak choroba Alzheimera czy Parkinsona, charakteryzują się postępującą utratą określonych populacji neuronów oraz gromadzeniem patologicznych białek. Objawiają się zaburzeniami pamięci, myślenia, ruchu, a także zmianami osobowości. Zaburzenia psychiczne, w tym depresja, schizofrenia, zaburzenia lękowe czy choroba afektywna dwubiegunowa, związane są z dysfunkcją sieci neuronalnych i układów neuroprzekaźnikowych, często w ścisłej interakcji z czynnikami środowiskowymi i genetycznymi.
Diagnostyka i leczenie tych schorzeń opiera się na różnorodnych technikach: obrazowaniu mózgu (tomografia komputerowa, rezonans magnetyczny, pozytonowa tomografia emisyjna), elektroencefalografii, badaniach neuropsychologicznych, testach genetycznych oraz farmakoterapii i rehabilitacji. Zrozumienie podstaw biologicznych tkanki nerwowej pozwala lepiej dobierać strategie terapeutyczne i projektować nowe leki.
Znaczenie badań nad tkanką nerwową dla nauki i technologii
Badania nad tkanką nerwową mają ogromne znaczenie nie tylko dla medycyny, ale też dla wielu innych gałęzi nauki i techniki. Poznanie zasad działania sieci neuronalnych inspiruje rozwój sztucznej inteligencji i uczenia maszynowego. Modele sieci neuronowych w informatyce wywodzą się z koncepcji biologicznych neuronów i synaps, choć w praktyce są ich uproszczeniem. Mimo to pozwoliły na powstanie systemów zdolnych do rozpoznawania obrazów, tłumaczenia języków czy gry w skomplikowane gry strategiczne.
Rozwijają się także dziedziny takie jak neuroinformatyka, neuroinżynieria i interfejsy mózg–komputer. Uczeni pracują nad systemami, które umożliwią bezpośrednie sterowanie protezami za pomocą aktywności mózgu, przywracanie komunikacji osobom sparaliżowanym, a nawet monitorowanie stanu zdrowia na podstawie sygnałów neuronalnych. Z kolei neuroetyka zajmuje się pytaniami o granice ingerencji w tkankę nerwową, ochronę prywatności danych neuronalnych oraz konsekwencje potencjalnego wzmacniania funkcji poznawczych.
Wszystko to sprawia, że tkanka nerwowa pozostaje jednym z centralnych przedmiotów badań współczesnej biologii, medycyny i nauk o człowieku. Zrozumienie jej budowy, funkcji i plastyczności ma kluczowe znaczenie dla wyjaśnienia natury świadomości, procesów uczenia się i pamięci, a także dla opracowania metod leczenia chorób, które najbardziej dotykają społeczeństwa o rosnącej długości życia.
FAQ – najczęściej zadawane pytania o tkankę nerwową
Czym różni się neuron od komórki glejowej?
Neuron to wyspecjalizowana komórka przewodząca impulsy nerwowe, posiadająca ciało komórki, dendryty i akson, zdolna do generowania potencjału czynnościowego. Komórki glejowe nie przewodzą impulsów w sposób typowy dla neuronów, ale pełnią funkcje podporowe, odżywcze, ochronne i regulacyjne. Tworzą osłonki mielinowe, utrzymują właściwe środowisko jonowe i biorą udział w naprawie uszkodzeń. Oba typy komórek są niezbędne do prawidłowego działania układu nerwowego.
Czy neurony mogą się regenerować i tworzyć się na nowo?
Możliwości regeneracji neuronów zależą od lokalizacji. W obwodowym układzie nerwowym uszkodzone aksony mogą częściowo odrastać przy udziale komórek Schwanna, choć proces ten jest powolny i nie zawsze kompletny. W ośrodkowym układzie nerwowym regeneracja jest znacznie ograniczona z powodu niekorzystnego środowiska i obecności czynników hamujących wzrost. Mimo to odkryto, że w niektórych obszarach mózgu, np. w hipokampie, zachodzi neurogeneza – powstawanie nowych neuronów z komórek macierzystych przez całe życie.
Na czym polega przewodzenie impulsu w neuronach mielinowych?
W neuronach mielinowych akson otoczony jest wielowarstwową osłonką mielinową, przerywaną w regularnych odstępach przewężeniami Ranviera. Potencjał czynnościowy nie rozchodzi się tu ciągłym frontem, lecz „przeskakuje” od jednego przewężenia do kolejnego. W tych miejscach skupione są kanały jonowe odpowiedzialne za depolaryzację. Skokowe przewodzenie znacząco przyspiesza transmisję sygnału i zmniejsza zużycie energii, ponieważ tylko niewielkie fragmenty błony wymagają aktywnego przywracania potencjału spoczynkowego.
Dlaczego choroby neurodegeneracyjne są tak trudne do leczenia?
Choroby neurodegeneracyjne, takie jak choroba Alzheimera czy Parkinsona, wiążą się z postępującą utratą określonych populacji neuronów oraz odkładaniem nieprawidłowych białek. Neurony w ośrodkowym układzie nerwowym mają bardzo ograniczoną zdolność do regeneracji, a powstałe uszkodzenia sieci połączeń są trudne do odtworzenia. Dodatkowo czynniki genetyczne, środowiskowe i związane ze starzeniem nakładają się na siebie, tworząc złożony obraz choroby. Obecne terapie głównie łagodzą objawy, a prace nad metodami spowalniającymi lub odwracającymi proces neurodegeneracji trwają.
Jak styl życia wpływa na funkcjonowanie tkanki nerwowej?
Styl życia ma znaczący wpływ na zdrowie tkanki nerwowej. Regularna aktywność fizyczna poprawia ukrwienie mózgu, wspiera neurogenezę w hipokampie i sprzyja lepszej plastyczności synaptycznej. Zrównoważona dieta, bogata w kwasy tłuszczowe omega-3, antyoksydanty i witaminy, wspomaga ochronę neuronów przed stresem oksydacyjnym. Sen jest kluczowy dla konsolidacji pamięci i regeneracji. Unikanie używek, przewlekłego stresu oraz dbanie o stymulację intelektualną i społeczną może zmniejszać ryzyko zaburzeń poznawczych w późniejszym wieku.