Transport aktywny należy do podstawowych procesów życiowych komórek, warunkując utrzymanie ich wewnętrznej równowagi, przewodnictwo nerwowe, skurcz mięśni czy funkcjonowanie nerek. Zrozumienie jego mechanizmów pozwala wyjaśnić, w jaki sposób komórki pokonują bariery energetyczne i środowiskowe, aby selektywnie gromadzić jony, metabolity oraz usuwać toksyny. W biologii komórki pojęcie to łączy zagadnienia z zakresu biofizyki, biochemii i fizjologii organizmów.
Podstawy transportu przez błonę komórkową
Błona komórkowa jest półprzepuszczalną barierą zbudowaną z podwójnej warstwy fosfolipidów, w którą wbudowane są liczne białka. Ta struktura decyduje o tym, jakie substancje mogą swobodnie dyfundować, a które muszą korzystać ze specjalnych mechanizmów. Małe cząsteczki niepolarne, jak tlen czy dwutlenek węgla, przechodzą przez błonę łatwo, natomiast jony i związki polarne wymagają udziału białek transportujących.
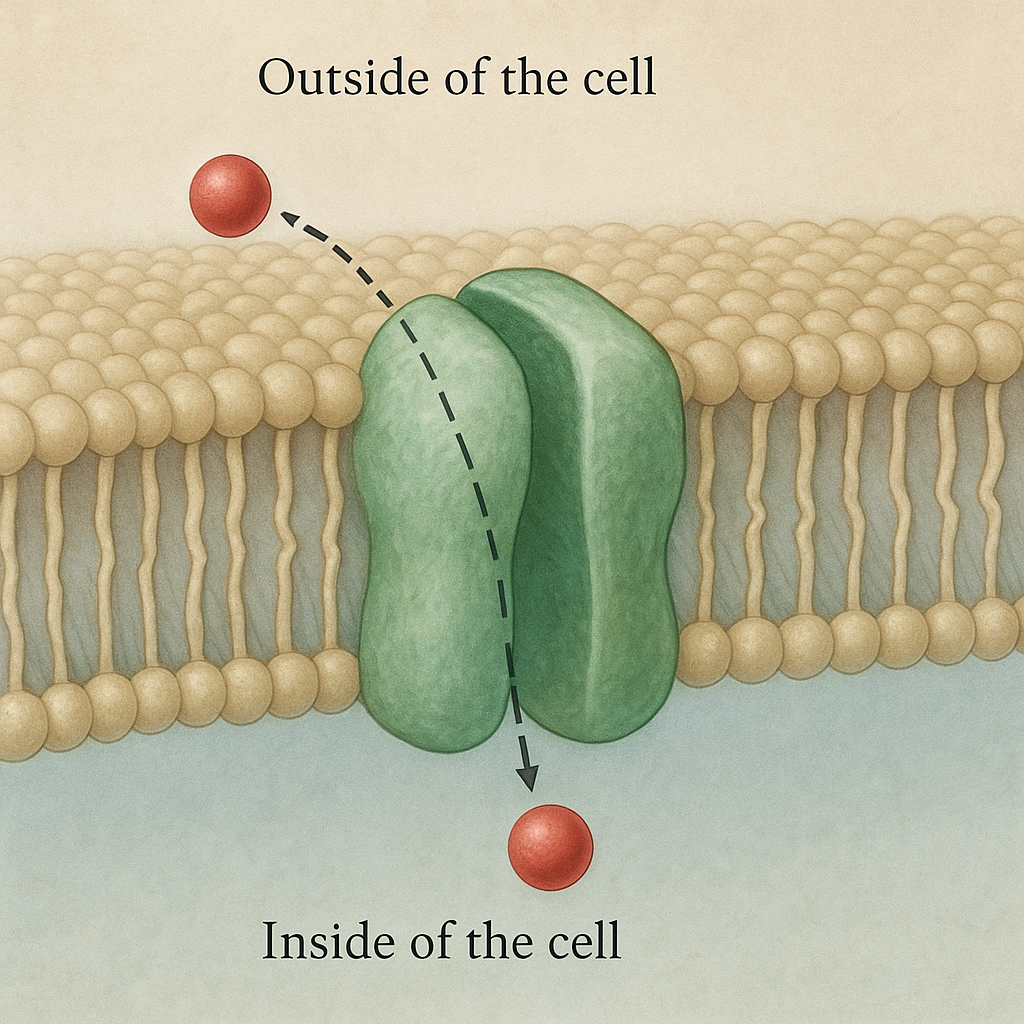
Pod względem energetycznym transport przez błonę można podzielić na bierny i aktywny. Transport bierny (dyfuzja prosta, osmoza, dyfuzja ułatwiona) zachodzi zgodnie z gradientem stężeń, czyli od miejsca o większym stężeniu do miejsca o mniejszym. Nie wymaga bezpośredniego nakładu energii metabolicznej komórki. W przeciwieństwie do niego transport aktywny umożliwia przemieszczanie substancji wbrew gradientowi stężeń lub ładunku elektrycznego.
Gradient elektrochemiczny to połączenie różnicy stężeń danej substancji po obu stronach błony i różnicy potencjałów elektrycznych. Wiele procesów biologicznych zależy od utrzymania określonych gradientów, np. gradientu jonów sodu i potasu w komórkach zwierzęcych. Ponieważ tendencją naturalną jest wyrównywanie gradientów, ich utrzymanie wymaga stałego wkładu energii – tutaj ujawnia się znaczenie transportu aktywnego.
Do udziału w transporcie konieczne są białka błonowe o wyspecjalizowanej budowie. Zalicza się do nich kanały jonowe, przenośniki (transportery) oraz pompy. W transport aktywny zaangażowane są przede wszystkim pompy i część przenośników sprzężonych z gradientem innych substancji. Każde z tych białek ma specyficzne miejsce wiązania dla danego jonu lub związku, co zapewnia wysoką selektywność i umożliwia precyzyjną kontrolę składu cytoplazmy.
Mechanizm i rodzaje transportu aktywnego
Transport aktywny polega na przemieszczaniu substancji przez błonę z obszaru o niższym stężeniu do obszaru o wyższym, czyli przeciwnie do kierunku dyfuzji samorzutnej. Aby było to możliwe, białka transportujące wykorzystują energię chemiczną lub energię gradientu innych jonów. W efekcie możliwe jest utrzymanie specyficznych różnic w składzie jonowym między wnętrzem komórki a jej otoczeniem, co warunkuje wiele procesów życiowych.
Można wyróżnić dwa główne typy transportu aktywnego:
- pierwotny – bezpośrednio sprzężony z hydrolizą ATP lub innym pierwotnym źródłem energii,
- wtórny – napędzany istniejącym już gradientem elektrochemicznym wytworzonym przez transport pierwotny.
W transporcie aktywnym pierwotnym kluczową rolę odgrywają pompy jonowe. Najbardziej znaną z nich jest pompa sodowo-potasowa (Na⁺/K⁺-ATP-aza), która transportuje trzy jony sodu na zewnątrz komórki i dwa jony potasu do jej wnętrza, zużywając przy tym jedną cząsteczkę ATP. Dzięki temu we wnętrzu komórki utrzymuje się wysokie stężenie potasu i niskie stężenie sodu, co ma zasadnicze znaczenie dla potencjału błonowego i pobudliwości komórek nerwowych oraz mięśniowych.
Transport aktywny wtórny wykorzystuje energię zgromadzoną w istniejącym gradiencie jonowym. Białka transportowe umożliwiają jednoczesne przenoszenie dwóch (rzadziej więcej) różnych substancji. Wyróżnia się:
- symport – obie substancje przemieszczają się w tym samym kierunku przez błonę,
- antyport – substancje przemieszczają się w przeciwnych kierunkach.
W symporcie jony sodu, spływające zgodnie z własnym gradientem elektrochemicznym, „ciągną” za sobą inne cząsteczki, np. glukozę lub aminokwasy, które przenoszone są wbrew swojemu gradientowi stężeń. Taki mechanizm występuje m.in. w komórkach nabłonka jelitowego. Antyport polega natomiast na wymianie jednej substancji na drugą, np. wymiennik sodowo-wapniowy (Na⁺/Ca²⁺) usuwa wapń z komórki, wykorzystując ruch sodu do jej wnętrza.
Wszystkie białka biorące udział w transporcie aktywnym charakteryzują się nasycalnością – istnieje maksymalna szybkość transportu, wynikająca z ograniczonej liczby miejsc wiążących na przenośniku. Kolejną cechą jest wysoka specyficzność substratowa, co oznacza, że białko transportowe rozpoznaje przede wszystkim jedną lub niewielką grupę podobnych cząsteczek. Mechanizm działania często osiąga się przez cykliczne zmiany konformacji białka, napędzane hydrolizą ATP lub przyłączaniem i odłączaniem jonów.
W części przypadków transport aktywny przebiega jako tzw. transport pęcherzykowy (endocytoza, egzocytoza). Choć jest on złożonym procesem obejmującym deformację błony i tworzenie pęcherzyków, także wymaga nakładu energii i może przebiegać wbrew gradientom. Pozwala to komórce na pobieranie dużych cząsteczek, a nawet całych mikroorganizmów, oraz na wydzielanie białek i innych substancji do przestrzeni zewnątrzkomórkowej.
Znaczenie transportu aktywnego w funkcjonowaniu komórek i organizmów
Utrzymanie homeostazy komórkowej wymaga precyzyjnie wyregulowanego składu jonowego i stężeń metabolitów. Transport aktywny jest kluczowy zarówno w pojedynczej komórce, jak i na poziomie całego organizmu. Bez niego nie byłoby możliwe przewodnictwo nerwowe, skurcz mięśni, funkcjonowanie zmysłów, wchłanianie substancji odżywczych czy regulacja objętości komórek.
Na poziomie pojedynczej komórki istotne jest utrzymanie odpowiedniego potencjału błonowego. Różnica ładunków między wnętrzem komórki a środowiskiem zewnętrznym powstaje dzięki nierównomiernemu rozmieszczeniu jonów, utrzymywanemu głównie przez pompy sodowo-potasowe oraz inne transportery. Potencjał błonowy spoczynkowy stanowi fundament dla powstawania potencjałów czynnościowych w neuronach i włóknach mięśniowych, co umożliwia przewodzenie impulsów i skurcz mięśni.
W nerkach transport aktywny odgrywa kluczową rolę w procesach filtracji, resorpcji i wydzielania. W cewkach nerkowych jony sodu są aktywnie pompowane z przesączu do komórek nabłonka, co umożliwia wtórny transport glukozy, aminokwasów i innych substancji. Następnie składniki te przechodzą do krwi, zapobiegając ich utracie z moczem. Jednocześnie aktywny transport jonów wodorowych i amonowych pomaga utrzymać równowagę kwasowo-zasadową organizmu.
W układzie pokarmowym transport aktywny umożliwia wchłanianie wielu składników odżywczych, niezależnie od ich stężenia w świetle przewodu pokarmowego. Przykładem jest wchłanianie glukozy w jelicie cienkim, które odbywa się m.in. poprzez symport z jonami sodu. Dzięki temu możliwe jest efektywne pozyskiwanie energii nawet w warunkach niskiego stężenia składników odżywczych.
W roślinach transport aktywny odpowiada za pobieranie związków mineralnych z gleby oraz ich dystrybucję w organizmie. Komórki włośnikowe korzeni aktywnie pobierają jony potasu, azotanów, fosforanów czy siarczanów wbrew gradientowi stężeń, co pozwala roślinie rosnąć nawet na ubogich glebach. Dodatkowo pompy protonowe w błonach komórkowych generują gradient pH i potencjału elektrycznego, służący jako napęd dla innych transporterów.
Duże znaczenie transportu aktywnego widoczne jest także w fizjologii mięśni. Jony wapnia odgrywają kluczową rolę w inicjowaniu skurczu, a ich stężenie w cytoplazmie jest precyzyjnie regulowane przez pompy wapniowe w siateczce sarkoplazmatycznej i błonie komórkowej. Po zakończonym skurczu wapń jest aktywnie usuwany z cytoplazmy z powrotem do siateczki, co umożliwia rozkurcz włókna mięśniowego i przygotowuje je do kolejnego cyklu pracy.
Rola energii w transporcie aktywnym
Transport aktywny jest procesem ściśle zależnym od dostępności energii metabolicznej. Najpowszechniej wykorzystywanym źródłem energii jest ATP, ale w niektórych systemach stosowane są również inne nośniki energii, jak gradient protonowy czy potencjał redoks. Zrozumienie, jak energia jest przekształcana i przekazywana do białek transportowych, pozwala wyjaśnić wydajność i regulację całego procesu.
Cząsteczka ATP magazynuje energię w wysokoenergetycznych wiązaniach fosforanowych. W trakcie hydrolizy ATP do ADP i fosforanu nieorganicznego uwalniana jest energia wykorzystywana przez białka transportujące. Struktury te posiadają specyficzne domeny wiążące ATP, a jego hydroliza wywołuje zmianę konformacji całego białka. Ta zmiana przestrzenna umożliwia przeniesienie jonu lub cząsteczki z jednej strony błony na drugą.
W przypadku wielu pomp jonowych (np. Na⁺/K⁺-ATP-azy czy Ca²⁺-ATP-azy) cykl transportowy składa się z kilku etapów: wiązanie jonów po jednej stronie błony, fosforylacja białka przez ATP, zmiana konformacji, uwolnienie jonów po drugiej stronie, defosforylacja i powrót do stanu wyjściowego. Proces ten jest ściśle regulowany, dzięki czemu transport nie zachodzi bez potrzeby, co pozwala uniknąć marnotrawienia energii.
W chloroplastach i mitochondriach występuje nieco inny sposób wykorzystania energii. Tworzony jest gradient protonowy po obu stronach wewnętrznych błon organelli, a przepływ protonów przez kompleks syntazy ATP napędza syntezę ATP. Ten sam gradient może być użyty do napędu transporterów wtórnie aktywnych, które wykorzystują ruch protonów w dół gradientu do transportu innych cząsteczek wbrew ich gradientom stężeń.
Energetyka transportu aktywnego ściśle łączy się z ogólną gospodarką energetyczną komórki. Duży udział w bilansie energetycznym komórki stanowi praca wykonywana przez pompy jonowe, zwłaszcza w komórkach o wysokiej aktywności elektrycznej, jak neurony. Szacuje się, że w tkance nerwowej mózgu człowieka znaczna część zużywanego ATP przeznaczana jest właśnie na utrzymanie gradientów sodowo-potasowych. W warunkach niedotlenienia (np. udaru) szybki spadek produkcji ATP prowadzi do załamania tego systemu i zaburzeń funkcjonowania komórek.
Transport aktywny może również korzystać z energii zawartej w gradientach jonowych generowanych przez inne procesy. Na przykład gradient sodu powstający dzięki pracy pompy Na⁺/K⁺-ATP-azy służy jako „magazyn energii” używany przez symportery glukozy czy aminokwasów. Jest to swoiste przeniesienie energii – ATP zużywane jest przez pompę, a zgromadzona w gradiencie energia wykorzystywana jest wtórnie przez inne białka.
Transport aktywny a choroby i leki
Prawidłowe funkcjonowanie układów transportu aktywnego jest niezbędne dla zdrowia. Mutacje w genach kodujących białka transportowe lub zaburzenia ich regulacji mogą prowadzić do wielu chorób. Z drugiej strony liczne leki działają poprzez modulowanie aktywności transporterów, co pozwala wpływać na ciśnienie krwi, przewodnictwo nerwowe czy działanie układu pokarmowego.
Przykładem choroby związanej z zaburzonym transportem jest mukowiscydoza. Wynika ona z mutacji w genie kodującym białko CFTR, które jest kanałem chlorkowym regulowanym przez ATP. Choć CFTR nie jest klasyczną pompą, jego działanie ściśle wiąże się z procesami aktywnego transportu jonów i wody w nabłonkach. Nieprawidłowe funkcjonowanie białka prowadzi do powstania gęstego śluzu w drogach oddechowych i przewodzie pokarmowym, co skutkuje nawracającymi infekcjami i problemami z trawieniem.
Innym przykładem są zaburzenia pracy pompy sodowo-potasowej. Toksyczne glikozydy nasercowe, takie jak digoksyna, hamują Na⁺/K⁺-ATP-azę w komórkach mięśnia sercowego. Prowadzi to do wzrostu stężenia sodu wewnątrzkomórkowego, co wtórnie hamuje wymiennik Na⁺/Ca²⁺ i zwiększa stężenie wapnia w cytoplazmie. W efekcie siła skurczu serca rośnie, co jest wykorzystywane w leczeniu niewydolności krążenia, jednak dawki muszą być ściśle kontrolowane ze względu na ryzyko działań niepożądanych.
Transport aktywny w nerkach jest celem działania wielu leków moczopędnych. Diuretyki pętlowe czy tiazydowe hamują konkretne transportery jonów w różnych odcinkach nefronu, co prowadzi do zmniejszonego wchłaniania sodu i wody oraz zwiększonego wydalania ich z moczem. Dzięki temu obniża się objętość krwi krążącej i ciśnienie tętnicze. Zrozumienie dokładnej lokalizacji i funkcji transporterów pozwoliło na opracowanie leków działających precyzyjnie na wybrane segmenty nefronu.
W onkologii istotną rolę odgrywają białka z rodziny transporterów ABC, odpowiedzialne za aktywne usuwanie z komórki wielu ksenobiotyków, w tym leków przeciwnowotworowych. Nadekspresja tych transporterów w komórkach nowotworowych może prowadzić do oporności na chemioterapię, gdyż leki są szybko wypompowywane na zewnątrz. Badania nad inhibitorami tych pomp mają na celu zwiększenie skuteczności terapii.
Transport aktywny jest także kluczowy w barierach ochronnych organizmu, takich jak bariera krew–mózg czy nabłonek jelitowy. Obecność specyficznych transporterów decyduje, które substancje przenikają do mózgu lub krążenia ogólnego. Ma to ogromne znaczenie dla projektowania leków o odpowiedniej biodostępności i zdolności przekraczania tych barier. Niektóre związki farmakologiczne są wręcz zaprojektowane tak, aby korzystać z istniejących transporterów, np. wykorzystując symportery określonych aminokwasów.
Transport aktywny w świecie mikroorganizmów i roślin
Mikroorganizmy, takie jak bakterie czy drożdże, w dużej mierze polegają na transporcie aktywnym, aby przetrwać w zmiennych i często niekorzystnych warunkach środowiskowych. Umożliwia im to pobieranie składników odżywczych z bardzo rozcieńczonych roztworów, usuwanie toksyn oraz regulację wewnętrznego pH. Zdolność do aktywnego transportu określonych związków często warunkuje sukces ekologiczny danej grupy mikroorganizmów.
Wiele bakterii wykorzystuje pompy protonowe do tworzenia gradientu elektrochemicznego, który napędza nie tylko transport substancji przez błonę, ale również ruch wici bakteryjnych. Gradient protonowy stanowi tu zatem uniwersalne źródło energii dla różnych procesów komórkowych. Pompy te odgrywają istotną rolę również w oporności na antybiotyki – aktywne wypompowywanie leków poza komórkę może ograniczać ich skuteczność.
W roślinach transport aktywny jest nieodłącznym elementem funkcjonowania tkanek przewodzących, aparatów szparkowych i komórek merystematycznych. Pompy protonowe w błonie plazmatycznej komórek korzeniowych generują gradient H⁺, który napędza wtórny transport kationów i anionów z gleby. Ten sam gradient uczestniczy w napędzie symportu sacharozy do floemu, co umożliwia jej dystrybucję z liści (gdzie jest produkowana w fotosyntezie) do tkanek zużywających i magazynujących.
Aparaty szparkowe, regulujące wymianę gazową i transpirację, również wykorzystują mechanizmy transportu aktywnego. Zmiany stężenia jonów potasu i anionów organicznych w komórkach szparkowych prowadzą do napływu lub wypływu wody, co zmienia ich turgor i powoduje otwieranie bądź zamykanie szparek. Proces ten jest ściśle kontrolowany przez sygnały środowiskowe, takie jak natężenie światła, wilgotność powietrza czy stężenie dwutlenku węgla.
W symbiozach roślin z mikroorganizmami, np. w brodawkach korzeniowych roślin motylkowych, transport aktywny umożliwia wzajemną wymianę jonów i metabolitów między partnerami. Białka transportowe obecne w błonach otaczających bakteroidy odpowiadają za dostarczanie substancji odżywczych bakteriom wiążącym azot oraz za eksport powstałych związków azotowych do tkanek roślinnych. Efektywność tych procesów wpływa na zdolność rośliny do wzrostu w warunkach niedoboru azotu mineralnego.
FAQ
Czym transport aktywny różni się od transportu biernego?
Transport aktywny wymaga nakładu energii, najczęściej w postaci ATP, i może zachodzić wbrew gradientowi stężeń lub ładunku elektrycznego. Uczestniczą w nim wyspecjalizowane białka, takie jak pompy i niektóre przenośniki, które zmieniają swoją konformację podczas cyklu pracy. Transport bierny, obejmujący dyfuzję prostą i ułatwioną oraz osmozę, nie zużywa bezpośrednio energii komórki i odbywa się zawsze zgodnie z gradientem elektrochemicznym. Dzięki temu jest energetycznie tani, lecz mniej kontrolowany.
Dlaczego transport aktywny jest tak ważny dla komórek nerwowych?
Komórki nerwowe polegają na precyzyjnie utrzymanych gradientach jonów sodu, potasu i wapnia, które umożliwiają powstawanie i przewodzenie potencjałów czynnościowych. Pompa Na⁺/K⁺-ATP-aza stale zużywa ATP, aby utrzymać wysokie stężenie potasu wewnątrz neuronu i niskie sodu, co warunkuje potencjał spoczynkowy błony. Zakłócenie jej działania, np. podczas niedotlenienia, szybko prowadzi do zaburzeń przewodnictwa nerwowego, obrzęku komórek i ich uszkodzenia, co ma istotne konsekwencje dla funkcjonowania mózgu.
Jakie są przykłady transportu aktywnego w przewodzie pokarmowym?
W jelicie cienkim wiele składników odżywczych, m.in. glukoza i aminokwasy, wchłaniane jest dzięki transportowi wtórnie aktywnemu, sprzężonemu z gradientem sodu. Symportery Na⁺/glukoza umożliwiają pobieranie cząsteczek cukru z wnętrza jelita do komórek nabłonkowych nawet przy niskim stężeniu glukozy w pokarmie. Następnie glukoza opuszcza komórkę do krwi innym mechanizmem transportu. Podobne zasady dotyczą wchłaniania wielu jonów i witamin, co zapewnia wysoką efektywność trawienia i odżywiania organizmu.
W jaki sposób leki mogą wpływać na transport aktywny?
Leki mogą zarówno hamować, jak i stymulować działanie wybranych transporterów. Diuretyki blokują aktywny transport jonów w nefronie, co nasila wydalanie sodu i wody. Glikozydy nasercowe hamują pompę Na⁺/K⁺-ATP-azę w mięśniu sercowym, pośrednio zwiększając stężenie wapnia w komórkach i wzmacniając skurcz. Inne substancje celują w transportery ABC, zmniejszając oporność komórek nowotworowych na chemioterapię. Z kolei niektóre leki są projektowane tak, by korzystać z istniejących transporterów jelitowych, poprawiając swoją biodostępność.
Czy transport aktywny zachodzi także u roślin i mikroorganizmów?
Tak, proces ten jest uniwersalny. U roślin pompy protonowe w błonach komórkowych generują gradient H⁺, który napędza pobieranie jonów mineralnych z gleby i transport sacharozy w łyku. Dzięki aktywnemu transportowi rośliny mogą rosnąć nawet na ubogich glebach. U mikroorganizmów gradient protonowy służy do napędu wielu transporterów, a także ruchu wici. Bakterie wykorzystują pompy do usuwania toksyn i antybiotyków, co sprzyja rozwojowi oporności, i pozwala im przetrwać w trudnych warunkach środowiskowych.