Wrzeciono kariokinetyczne jest jednym z kluczowych elementów maszynerii komórkowej, dzięki któremu możliwe jest precyzyjne rozdzielenie materiału genetycznego podczas podziału komórki. Jego struktura, dynamika oraz regulacja stanowią fascynujący przykład tego, jak złożone i jednocześnie niezwykle precyzyjne mogą być procesy zachodzące we wnętrzu organizmów żywych. Zrozumienie budowy i działania wrzeciona ma znaczenie zarówno dla podstawowej biologii komórki, jak i dla medycyny – zwłaszcza w kontekście nowotworów i terapii przeciwnowotworowych.
Definicja i znaczenie wrzeciona kariokinetycznego
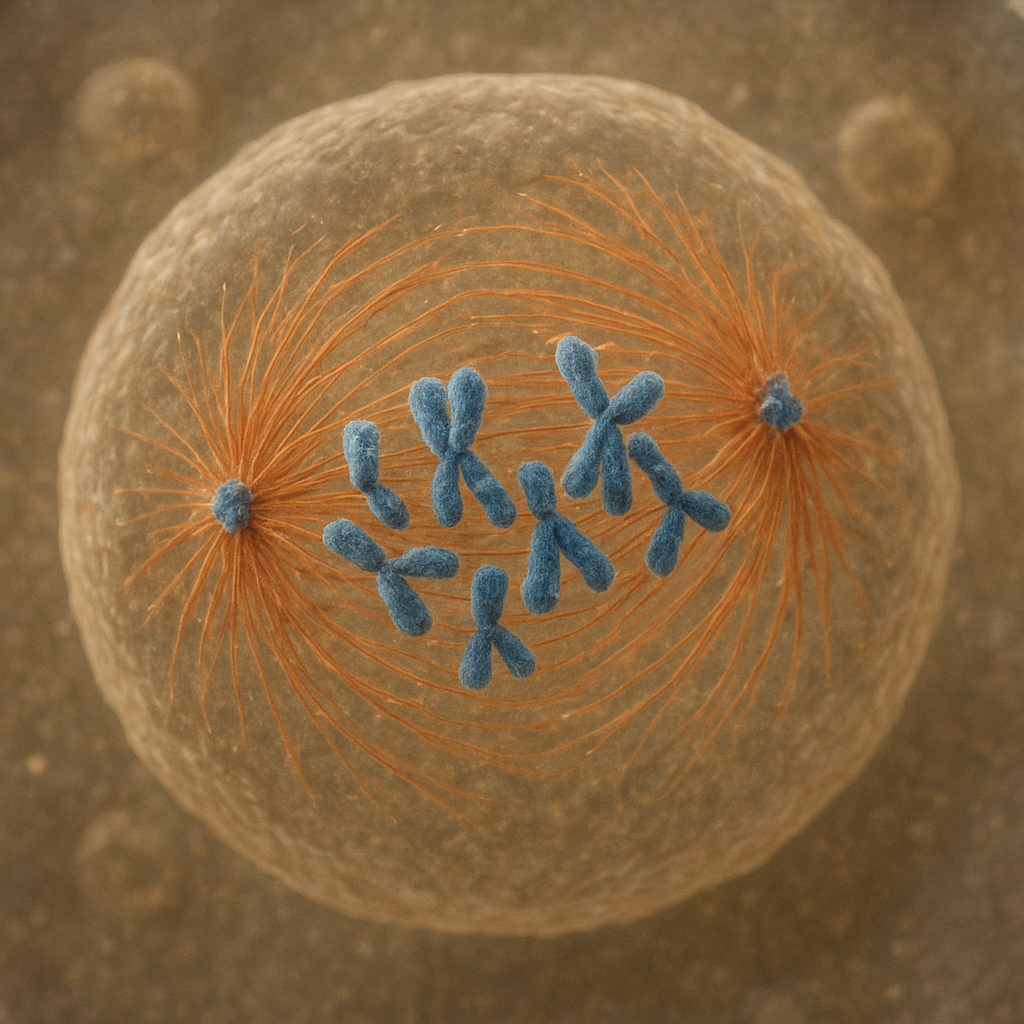
Wrzeciono kariokinetyczne (często nazywane wrzecionem podziałowym lub mitotycznym) to dynamiczna struktura białkowa powstająca w komórkach eukariotycznych podczas podziału jądra komórkowego – mitozy i mejozy. Jego główną funkcją jest zapewnienie, aby każda komórka potomna otrzymała dokładnie taki sam, prawidłowo skopiowany zestaw chromosomów. Wrzeciono formuje się z mikrotubul, białek motorowych oraz licznych białek regulatorowych, które wspólnie tworzą wysoce zorganizowany, lecz stale przebudowujący się układ.
Znaczenie wrzeciona kariokinetycznego jest fundamentalne. Błąd w jego funkcjonowaniu może prowadzić do nierównomiernego rozdziału chromosomów, czyli do aneuploidii. Jest to stan, w którym komórka zawiera nieprawidłową liczbę chromosomów. Aneuploidia jest często obserwowana w komórkach nowotworowych i jest uznawana za jedną z przyczyn niestabilności genomu. Dlatego zrozumienie mechanizmów, które rządzą działaniem wrzeciona, ma ogromne znaczenie zarówno dla teorii ewolucji komórkowej, jak i dla praktycznej medycyny.
W komórkach zwierzęcych organizacja wrzeciona związana jest z wyspecjalizowanymi strukturami zwanymi centrosomami, które pełnią rolę głównych centrów organizacji mikrotubul. W komórkach roślinnych, pozbawionych typowych centrosomów, wrzeciono tworzy się poprzez samoorganizację mikrotubul wokół chromosomów. Pokazuje to, że choć ogólny cel – równe rozdzielenie materiału genetycznego – pozostaje ten sam, to ewolucja wykształciła różne strategie jego osiągania.
Dla biologii komórki wrzeciono kariokinetyczne jest modelowym przykładem układu, w którym przeplatają się procesy mechaniczne i biochemiczne. Zachowanie mikrotubul, przyłączanie się białek motorowych, fosforylacja regulatorów cyklu komórkowego – wszystkie te elementy składają się na spójny, choć skomplikowany, program podziału komórki. Bez sprawnie funkcjonującego wrzeciona podziały komórkowe byłyby chaotyczne, co w konsekwencji uniemożliwiłoby stabilne dziedziczenie informacji genetycznej.
Budowa wrzeciona kariokinetycznego
Wrzeciono kariokinetyczne ma charakter przestrzennej, trójwymiarowej struktury, która rozciąga się pomiędzy dwoma przeciwległymi biegunami komórki. Najbardziej charakterystycznym komponentem wrzeciona są mikrotubule – długie, cylindryczne włókna zbudowane z heterodimerów tubuliny alfa i beta. Mikrotubule cechuje dynamiczna niestabilność: nieustannie wydłużają się i skracają, co jest kluczowe dla ich funkcji podczas mitozy.
Wyróżnia się kilka głównych klas mikrotubul wrzeciona:
- Mikrotubule kinetochorowe – łączące bieguny wrzeciona z kinetochorami na chromosomach;
- Mikrotubule biegunowe (interpolarowe) – pochodzące z przeciwległych biegunów wrzeciona i nakładające się na siebie w centralnej części;
- Mikrotubule astralne – promieniście rozchodzące się od centrosomów w stronę kory komórkowej.
Mikrotubule kinetochorowe są bezpośrednio odpowiedzialne za ruch chromosomów. Przyczepiają się one do wyspecjalizowanych kompleksów białkowych zlokalizowanych na centromerach chromosomów – do kinetochorów. Kinetochor jest miejscem integracji sygnałów mechanicznych i chemicznych: z jednej strony odbiera siły generowane przez kurczące się mikrotubule i białka motorowe, z drugiej – wysyła sygnały kontrolujące punkt kontrolny wrzeciona, który nie pozwala na przejście do anafazy, dopóki wszystkie chromosomy nie zostaną prawidłowo przyłączone.
Mikrotubule biegunowe nakładają się na siebie w rejonie równika komórki. W tym obszarze działają białka motorowe, takie jak kinezyny, które przesuwają się wzdłuż mikrotubul i generują siły odpychające bieguny wrzeciona, co prowadzi do jego wydłużenia. Mikrotubule astralne z kolei zakotwiczają wrzeciono w korze komórkowej, dzięki czemu cały aparat podziałowy może być prawidłowo zorientowany w przestrzeni, co jest ważne np. dla asymetrycznych podziałów komórek macierzystych.
W komórkach zwierzęcych istotną rolę odgrywają centrosomy, zawierające parę centrioli otoczonych macierzą białkową – pericentriolar material (PCM). Z PCM wychodzą mikrotubule i to tam ulokowane są liczne czynniki niezbędne do ich nukleacji. W komórkach roślinnych oraz w niektórych komórkach zwierzęcych bez dojrzałych centrosomów, mikrotubule mogą organizować się w oparciu o chromosomy i białka związane z DNA, pokazując elastyczność i zdolność komórki do samoorganizacji.
W skład wrzeciona wchodzą liczne białka motorowe – w tym kinezyny i dyneina. Kinezyny zazwyczaj przemieszczają się w kierunku dodatniego końca mikrotubuli, natomiast dyneina w kierunku końca ujemnego. To ruch tych białek przekształca energię chemiczną ATP w energię mechaniczną, niezbędną do generowania sił przesuwających chromosomy i oddalających od siebie bieguny wrzeciona. Bez ich skoordynowanego działania samo istnienie wrzeciona byłoby niestabilne i chaotyczne.
Istnieje również grupa białek nie-motorowych, które stabilizują i łączą mikrotubule ze sobą oraz z innymi strukturami komórkowymi. Należą do nich białka MAP (microtubule-associated proteins), białka sieciujące mikrotubule, a także liczne kinazy i fosfatazy regulujące stan fosforylacji kluczowych komponentów wrzeciona. Te modyfikacje posttranslacyjne są istotnym elementem kontroli czasowej – pozwalają komórce włączać i wyłączać określone funkcje w zależności od fazy mitozy.
Powstawanie i funkcjonowanie wrzeciona w cyklu komórkowym
Tworzenie wrzeciona kariokinetycznego jest ściśle zsynchronizowane z cyklem komórkowym. Proces ten rozpoczyna się w późnej fazie G2 oraz w profazie, kiedy to dochodzi do kondensacji chromosomów i przygotowania komórki do wejścia w mitozę. Aktywacja kompleksu cyklina B–CDK1 jest kluczowym wydarzeniem, które inicjuje przejście z fazy G2 do M i uruchamia szereg przemian strukturalnych, w tym reorganizację cytoszkieletu mikrotubulowego.
W profazie centrosomy zaczynają się oddalać od siebie, przemieszczając się w stronę przeciwległych biegunów komórki. Jednocześnie sieć mikrotubul interfazowych ulega depolimeryzacji, a w jej miejsce zaczynają wyrastać liczne, krótkie mikrotubule mitotyczne. W komórkach roślinnych, zamiast migracji centrosomów, obserwuje się stopniowe formowanie dwubiegunowego układu mikrotubul wokół jądra komórkowego, przy dużym udziale białek związanych z chromatyną.
W prometafazie dochodzi do rozpadu otoczki jądrowej, co umożliwia mikrotubulom wrzeciona bezpośredni kontakt z chromosomami. Zdarzenie to jest kluczowe, gdyż dopiero teraz mikrotubule mogą przyczepiać się do kinetochorów. Proces poszukiwania i przechwytywania kinetochorów przez mikrotubule opiera się na ich dynamicznej niestabilności – liczne włókna spontanicznie rosną i skracają się, aż natrafią na kinetochor, do którego zostają ustabilizowane przez odpowiednie białka.
W metafazie wszystkie chromosomy powinny być już przyłączone do wrzeciona w taki sposób, że siostrzane chromatydy są związane z przeciwległymi biegunami. Ustawiają się one wtedy w płaszczyźnie równikowej komórki, tworząc tzw. płytkę metafazową. Jest to moment, w którym działa punkt kontrolny wrzeciona (spindle assembly checkpoint), monitorujący, czy każdy kinetochor jest prawidłowo przyłączony do mikrotubul oraz czy chromosomy znajdują się pod odpowiednim napięciem mechanicznym.
Dopiero po spełnieniu tych warunków komórka może wejść w anafazę. Uruchomienie kompleksu APC/C (anaphase-promoting complex/cyclosome) prowadzi do degradacji białka sekuryny, co uwalnia enzym separazę. Separaza rozcina kohezyjny łączące siostrzane chromatydy, co pozwala im rozdzielić się i przemieszczać w stronę przeciwległych biegunów komórki. Ruch chromatyd jest napędzany zarówno przez skracanie mikrotubul kinetochorowych przy biegunach, jak i przez aktywność białek motorowych na samych chromosomach.
W późniejszej części anafazy i w telofazie dochodzi do wydłużenia całego wrzeciona – mikrotubule biegunowe nakładają się na siebie i poślizgują dzięki działaniu kinezyn, co zwiększa odległość pomiędzy biegunami. Jednocześnie mikrotubule astralne współpracują z korą komórkową, pomagając ustalić miejsce powstania pierścienia kurczliwego odpowiedzialnego za cytokinezę, czyli podział cytoplazmy.
W telofazie chromosomy docierają do biegunów, ulegają dekondensacji i wokół nich odbudowuje się otoczka jądrowa. Wrzeciono kariokinetyczne stopniowo zanika: mikrotubule depolimeryzują, a białka wrzeciona wracają do stanów typowych dla interfazowej organizacji cytoszkieletu. Ciekawym elementem jest tu przejściowa struktura nazywana ciałkiem środkowym (midbody), powstająca z pozostałości mikrotubul interpolarnych i uczestnicząca w zakończeniu cytokinezy.
Analogiczne, choć bardziej złożone procesy zachodzą w mejozie, gdzie powstają komórki rozrodcze o zredukowanej liczbie chromosomów. W mejozie I wrzeciono odpowiada za rozdzielenie par homologicznych chromosomów, natomiast w mejozie II – za rozdzielenie chromatyd siostrzanych, podobnie jak w mitozie. Dodatkowo, w trakcie gametogenezy w wielu organizmach dochodzi do asymetrycznych podziałów komórki jajowej, w których wrzeciono zostaje silnie przesunięte w stronę jednego z biegunów, co prowadzi do powstania ciałek kierunkowych i jednej dużej komórki jajowej bogatej w cytoplazmę.
Funkcjonowanie wrzeciona kariokinetycznego jest zatem wynikiem skoordynowanego działania wielu szlaków sygnałowych cyklu komórkowego, dynamicznych przemian mikrotubul oraz precyzyjnie działających białek motorowych. Ten złożony system zapewnia, że podziały komórkowe przebiegają z dużą dokładnością, co jest niezbędne dla prawidłowego rozwoju i utrzymania integralności organizmu.
Znaczenie wrzeciona kariokinetycznego dla zdrowia i nauki
Wrzeciono kariokinetyczne stanowi kluczowy element, na którym koncentruje się uwaga wielu dziedzin nauki – od biologii komórki, przez genetykę, aż po farmakologię i onkologię. Jednym z najważniejszych zagadnień jest jego rola w powstawaniu chorób nowotworowych. Komórki nowotworowe często wykazują liczne nieprawidłowości w budowie i funkcjonowaniu wrzeciona: nadliczbowe centrosomy, zaburzone przyłączanie mikrotubul do kinetochorów czy wadliwe punkty kontrolne cyklu komórkowego. Skutkiem tych defektów jest niestabilność chromosomowa, która sprzyja dalszym mutacjom i adaptacji komórek nowotworowych do niekorzystnych warunków.
Ze względu na centralną rolę wrzeciona w podziale komórkowym, wiele leków przeciwnowotworowych zostało zaprojektowanych tak, aby zakłócać jego funkcjonowanie. Klasycznym przykładem są alkaloidy barwinka (np. winkrystyna, winblastyna) oraz taksany (np. paklitaksel). Pierwsza grupa związków blokuje polimeryzację mikrotubul, natomiast taksany stabilizują już istniejące mikrotubule, uniemożliwiając ich prawidłową depolimeryzację. Oba typy leków prowadzą do zatrzymania komórek w mitozie i ostatecznie do ich śmierci, co wykorzystuje się w terapii nowotworów.
Nowsze strategie terapeutyczne koncentrują się na bardziej specyficznych celach, takich jak białka motorowe wrzeciona (np. Eg5/KIF11) czy wybrane kinazy regulujące funkcję kinetochorów. Inhibitory tych białek mają potencjał wywoływania zatrzymania mitozy głównie w komórkach o dużej aktywności proliferacyjnej, typowej dla wielu guzów. Badania nad takimi lekami mają na celu zwiększenie selektywności działania oraz zmniejszenie skutków ubocznych w porównaniu z tradycyjnymi cytostatykami.
Znaczenie wrzeciona kariokinetycznego nie ogranicza się jednak do onkologii. Zaburzenia w podziałach komórkowych na wczesnych etapach rozwoju zarodkowego mogą prowadzić do ciężkich wad rozwojowych i chorób genetycznych. Przykładem są trisomie, takie jak zespół Downa (trisomia chromosomu 21), które powstają na skutek błędów w segregacji chromosomów podczas mejozy w komórkach rozrodczych rodziców. Choć ostateczne przyczyny takich błędów są złożone, nieprawidłowości w działaniu wrzeciona stanowią ważny element tej układanki.
Wrzeciono jest także obiektem intensywnych badań podstawowych. Modele matematyczne i symulacje komputerowe pozwalają analizować, w jaki sposób lokalne interakcje pomiędzy mikrotubulami, białkami motorowymi i chromatyną mogą prowadzić do powstania uporządkowanej, dwubiegunowej struktury. Takie badania dostarczają ogólniejszej wiedzy o zasadach samoorganizacji w systemach biologicznych, która może mieć zastosowanie również w innych dziedzinach, na przykład w biotechnologii i inżynierii biomateriałów.
Techniki mikroskopowe, w tym mikroskopia fluorescencyjna wysokiej rozdzielczości, mikroskopia konfokalna czy mikroskopia dwufotonowa, umożliwiają śledzenie w czasie rzeczywistym zachowania poszczególnych składników wrzeciona w żywych komórkach. Z kolei metody biochemiczne i biofizyczne pozwalają badać wiązanie białek do mikrotubul, siły generowane przez pojedyncze cząsteczki kinezyn lub dyneiny oraz wpływ modyfikacji potranslacyjnych na dynamikę mikrotubul. Wszystko to przekłada się na coraz dokładniejszy obraz tego, jak funkcjonuje wrzeciono w warunkach fizjologicznych i patologicznych.
W kontekście rozwoju organizmów wielokomórkowych wrzeciono kariokinetyczne uczestniczy również w procesach różnicowania komórek. Kierunek i płaszczyzna podziału komórki mogą determinować, jakie sygnały środowiskowe otrzymają komórki potomne, a tym samym – jaki będzie ich dalszy los. Precyzyjne ustawienie wrzeciona względem osi tkanki jest więc jednym z mechanizmów kontroli architektury rozwijającego się organizmu. Zaburzenia w tej regulacji mogą prowadzić do nieprawidłowego kształtowania tkanek, przerostów lub degeneracji.
Wreszcie, zrozumienie działania wrzeciona kariokinetycznego ma znaczenie dla badań nad starzeniem się komórek. Z wiekiem rośnie częstość występowania błędów w podziale komórek somatycznych, co może przyczyniać się do gromadzenia uszkodzeń genomu, spadku funkcjonalności tkanek oraz wzrostu ryzyka transformacji nowotworowej. Analiza zmian w dynamice mikrotubul, funkcji centrosomów i sprawności punktów kontrolnych wrzeciona w starzejących się komórkach stanowi ważny obszar badań w biologii starzenia.
FAQ – najczęściej zadawane pytania
Czym dokładnie jest wrzeciono kariokinetyczne i z czego się składa?
Wrzeciono kariokinetyczne to struktura odpowiedzialna za równomierny rozdział chromosomów podczas podziału komórki. Zbudowane jest głównie z mikrotubul powstałych z białka tubuliny, białek motorowych (kinezyn i dyneiny) oraz licznych białek regulatorowych. Tworzy ono dwubiegunowy układ rozciągający się między przeciwnymi biegunami komórki, do którego chromosomy przyłączają się za pomocą kinetochorów zlokalizowanych na centromerach.
Jaką rolę pełni wrzeciono kariokinetyczne w mitozie?
Podczas mitozy wrzeciono kariokinetyczne organizuje i kontroluje ruch chromosomów. Najpierw jego mikrotubule przyłączają się do kinetochorów, następnie ustawiają wszystkie chromosomy w płaszczyźnie równikowej komórki, a po aktywacji odpowiednich szlaków doprowadzają do rozdzielenia chromatyd siostrzanych. Skracanie mikrotubul oraz działanie białek motorowych przesuwa chromatydy ku biegunom komórki, co zapewnia, że każda komórka potomna otrzyma identyczny zestaw genów.
Co się dzieje, gdy wrzeciono kariokinetyczne działa nieprawidłowo?
Nieprawidłowe działanie wrzeciona może skutkować błędnym rozdziałem chromosomów, prowadząc do aneuploidii, czyli obecności niewłaściwej liczby chromosomów w komórce. Taki stan sprzyja niestabilności genomu i jest charakterystyczny dla wielu nowotworów. Wczesne błędy w mejozie mogą powodować ciężkie choroby genetyczne, takie jak trisomie. Komórki dysponują mechanizmami kontrolnymi, które starają się wykrywać defekty wrzeciona, ale ich niesprawność potęguje ryzyko chorób.
Dlaczego wrzeciono kariokinetyczne jest celem leków przeciwnowotworowych?
Komórki nowotworowe dzielą się intensywniej niż zdrowe, dlatego są szczególnie wrażliwe na zaburzenia procesu mitozy. Leki przeciwnowotworowe, które oddziałują na mikrotubule wrzeciona, mogą blokować podział komórek i wywoływać ich śmierć. Alkaloidy barwinka hamują polimeryzację mikrotubul, a taksany stabilizują je, uniemożliwiając ich dynamiczne przebudowy. W rezultacie komórki zatrzymują się w mitozie i nie są w stanie prawidłowo zakończyć podziału, co ogranicza wzrost guza.
Czym różni się wrzeciono mitotyczne od mejotycznego?
Wrzeciono mitotyczne uczestniczy w podziale komórek somatycznych i prowadzi do powstania dwóch komórek potomnych o identycznym zestawie chromosomów. Wrzeciono mejotyczne działa w komórkach rozrodczych i odpowiada za dwa następujące po sobie podziały: w mejozie I rozdziela chromosomy homologiczne, a w mejozie II chromatydy siostrzane. Efektem jest powstanie komórek o zredukowanej o połowę liczbie chromosomów, co jest niezbędne do prawidłowego zapłodnienia.